
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
mAgCl] n Ag+ (n -х)NO3‾ }+ - частица или гранула
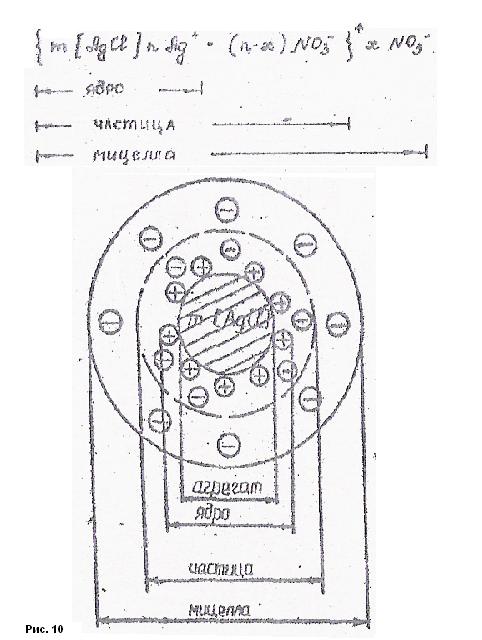
Строение коллоидной частицы.(внимательно прочитать, продумать и выполнить практическую работу своего варианта)
на примере золя хлорида серебра.
В основе реакция AgNO3 + KCl= AgCl  + KNO3
+ KNO3
1моль 1 моль
Если взять одинаковое количество исходных веществ то при взаимодействии выпадает осадок и золя не образуется. Необходим избыток одного из растворов. В случае избытка нитрата ( AgNO3 ) получаются частицы золя. AgNO3-стабилизатор. В растворе AgNO3 ↔ Ag+ + NO3- (ионы стабилизатора)
В центре коллоидной частицы расположен агрегат , который состоит из большого числа(m) молекул нерастворимого в воде вещества (AgCl) и имеет кристаллическое строение. Агрегат - [mAgCl] .
На поверхности агрегата фиксируются или адсорбируются ионы стабилизатора в количествеn, которые есть в агрегате и они способны достраивать кристаллическую решётку. Это Ag+ -потенциалопределяющие ионы. Их количество n. Образуется ядро.
[mAgCl] n Ag+ - ядро .
Вокруг ядра располагается и другие ионы стабилизатора NO3‾ противоионы. Количество противоионов меньше (n - х). Ионы стабилизатора образуют адсорбционный слой.
Ядро с адсорбционным слоем образует коллоидную частицу (гранулу).
{ [mAgCl] n Ag+ (n -х)NO3‾ }+ - частица или гранула
Она имеет заряд, соответствующий знаку потенциалопределяющих ионов. Оставшиеся противоионы образуют диффузный слой мицеллы х NO3‾
{ [mAgCl] n Ag+ (n - х)NO3‾ }+ х NO3‾ - мицелла
В диффузном слое противоионы свободно перемещаются и окружены молекулами воды . И при перемещении в сторону соответствующего электрода, несу на "себе" воду (электроосмос).
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|