
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тема: Основное уравнение молекулярно-кинетической теории газов.
Тема: Основное уравнение молекулярно-кинетической теории газов.
Группа: МОЦИ - 264
Дата: 01.03.2021 г.
Студенты должны знать: свойства идеального газа, макро и микроскопические параметры идеального газа.
Студенты должны уметь: описать модель идеального газа.
План
1. Основное уравнение молекулярно-кинетической теории газов.
2. Анализ основного уравнения молекулярно-кинетической теории газов.
1. Основное уравнение молекулярно-кинетической теории газов.
Выведем основное уравнение молекулярно-кинетической теории газов. Пусть в некотором объеме есть молекулы, масса каждой mo, их число равно N, и движутся они со скоростью v (очевидно, что скорости у всех молекул различны, однако среднее значение модуля скорости v вполне определенное)
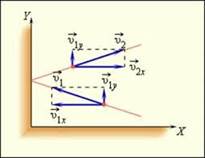
При каждом ударе молекулы действуют на стенку сосуда с некоторой силой. Складываясь друг с другом, силы ударов отдельных частиц образуют некоторую силу давления, постоянно действующую на стенку, а значит и давление.
От чего же зависит давление газа?
Во-первых, от массы: чем больше масса молекулы, тем сильнее удар, значит здесь прямая пропорциональная зависимость давления р от массы mo
Во-вторых, от скорости: чем быстрее движутся молекулы, тем сильнее будут удары, а значит и давление.
В-третьих, есть еще одна зависимость от скорости: чем быстрее движутся молекулы, тем чаще удары, а значит и давление.
В-четвертых, давление газа зависит от числа молекул в данном сосуде, а точнее от концентрации n.
Концентрация – физическая величина, равная числу молекул, содержащихся в единице объема (n = N/V )
В результате получаем: давление газа прямо пропорционально концентрации частиц, массе частицы и квадрату скорости частицы:
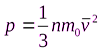
Это и есть основное уравнение молекулярно-кинетической теории идеального газа. Оно устанавливает соотношение между давлением газа и его микроскопическими параметрами – массой молекул, их средней скоростью и концентрацией.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|