- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Порядок заполнения ячеек.
Атомное ядро - центральная часть атома, состоящая из Z протонов и N нейтронов, в которой сосредоточена основная масса атомов.
Протон. p- Элементарная частица, входит в состав ядра атома. Масса 1,00728 а.е.м., заряд +1,6·10-19 Кл (по абсолютной величине равен заряду электрона). Число протонов в ядре атома данного химического элемента равно атомному номеру элемента и определяет место элемента в периодической системе.
Нейтрон. Электрически нейтральная элементарная частица с массой 1,00866 а.е.м.
Электрон (обозначается e) - элементарная частица, несущая отрицательный заряд, равный 1,60217733·10-19 Кл (элементарный заряд). Масса е = 0,000548579903 а.е.м. Электрон примерно в 2000 раз легче нуклона. Спин электрона равен 1/2 h/2p. Число электронов в атоме равно числу протонов. (Определяется по порядковому номеру элемента в периодической системе элементов - Z).
Гипотеза Планка — гипотеза, заключающаяся в том, что при тепловом излучении энергия испускается и поглощается не непрерывно, а отдельными квантами (порциями). Каждая такая порция-квант имеет энергию, пропорциональной частоте ν излучения:
Постулаты Н.Бора
1. Электрон вращается вокруг ядра по строго определенным орбитам;
2. Энергия излучается и поглощается при переходе с орбиты на орбиту.
Л. де Бройль предположил, что корпускулярно-волновыми свойствами обладает не только фотон, но и любая другая частица, движущаяся со скоростью v. Он получил уравнение, связывающее скорость движения частицы, с длиной волны производимого ей электромагнитного излучения (уравнение де Бройля):
λ = h / mv,
Бор высказал предположения, которые были названы постулатами Бора.
· Первый постулат (постулат стационарных состояний): электроны движутся только по определенным (стационарным) орбитам. При этом, даже двигаясь с ускорением, они не излучают энергию.
· Второй постулат (правило частот): излучение и поглощение энергии в виде кванта света происходит лишь при переходе электрона из одного стационарного состояния в другое. Величина светового кванта равна разности энергий тех стационарных состояний, между которыми совершается скачок электрона.
Состояние каждого электрона в атоме обычно описывают с помощью четырех квантовых чисел: главного (n), орбитального (l), магнитного (m) и спинового (s). Первые три характеризуют движение электрона в пространстве, а четвертое - вокруг собственной оси.
Главное квантовое число (n). Определяет энергетический уровень электрона, удаленность уровня от ядра, размер электронного облака. Принимает целые значения (n = 1, 2, 3 ...) и соответствует номеру периода.
Орбитальное квантовое число (l) характеризует геометрическую форму орбитали. Принимает значение целых чисел от 0 до (n - 1). Независимо от номера энергетического уровня, каждому значению орбитального квантового числа соответствует орбиталь особой формы.
Для
l=0 s- подуровень, s- орбиталь – орбиталь сфера
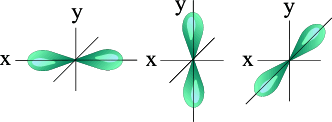
l=1 p- подуровень, p- орбиталь – орбиталь гантель
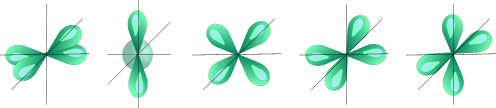
l=2 d- подуровень, d- орбиталь – орбиталь сложной формы
f-подуровень, f-орбиталь – орбиталь еще более сложной формы
|
|
|
| S - орбиталь | Три p – орбитали |
|
| Пять d – орбиталей |
Магнитное квантовое число (m) характеризует положение электронной орбитали в пространстве и принимает целочисленные значения от -I до +I, включая 0. Это означает, что для каждой формы орбитали существует (2l + 1) энергетически равноценных ориентации в пространстве.
Спиновое квантовое число (s) характеризует магнитный момент, возникающий при вращении электрона вокруг своей оси. Принимает только два значения +1/2 и –1/2 соответствующие противоположным направлениям вращения.
Энергетический уровень — это совокупность орбиталей, которые имеют одинаковые значения главного квантового числа. Число энергетических уровней атома равно номеру периода, в котором он расположен.
Энергетический подуровень — совокупность орбиталей с одинаковыми значениями главного и орбитального квантовых чисел. Энергетический подуровень обозначается латинскими буквами: s, p, d, f.
Электронный слой - это совокупность электронов, находящихся на одном энергетическом уровне.
Электронная оболочка атома — область пространства вероятного местонахождения электронов, характеризующихся одинаковым значением главного квантового числа n.
Атомная орбиталь - область пространства в атоме, где наиболее часто находится электрон.
Принцип Паули. В атоме не может быть двух электронов, у которых значения всех квантовых чисел (n, l, m, s) были бы одинаковы, т.е. на каждой орбитали может находиться не более двух электронов (c противоположными спинами).
Под обозначениями подоболочек проставлены значения главного (n) и орбитального (l) квантовых чисел, характеризующие последовательно заполняющиеся подоболочки. В соответствии с Паули принципом ёмкость каждой электронной оболочки равна 2n2, а ёмкость каждой подоболочки - 2(2l + 1).
Правило Хунда. Атом в основном состоянии должен иметь максимально возможное число неспаренных электронов в пределах определенного подуровня.
Порядок заполнения ячеек.
| 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p |
Правило Клечковского (принцип наименьшей энергии). В основном состоянии каждый электрон располагается так, чтобы его энергия была минимальной. Чем меньше сумма (n + l), тем меньше энергия орбитали. При заданном значении (n + l) наименьшую энергию имеет орбиталь с меньшим n. Энергия орбиталей возрастает в ряду:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d < 4f < 6p < 7s
Электроны различаются своей энергией, чем дальше от ядра расположены электроны, тем большим запасом энергии они обладают. Всегда в атоме имеются электроны с близкими значениями энергии, которые и образуют электронные слои в оболочке атома.
Число электронных слоёв равно номеру периода в периодической системе. Максимальное число электронов на слое можно найти с помощью формулы N=2n2, где N-число электронов на слое, n-номер слоя. На первом электронном слое будет 2 электрона, на втором-8, третьем-18, четвёртом-32. Но на внешнем электронном слое не может быть более 8 электронов, а для первого слоя не более 2. Это необходимо учитывать при распределении электронов по энергетическим слоям.
Рассмотрим несколько примеров заполнения электронных оболочек.
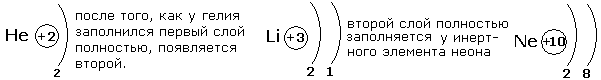
После заполнения второго слоя до восьми электронов появляется третий слой.


Третий электронный слой заполняется до максимального числа -18 электронов. После этого начинает заполняться внешний четвёртый слой до 8 электронов.
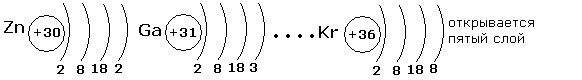
Внешний электронный слой заполняется у элементов главных подгрупп, причём число электронов соответствует номеру группы. У элементов побочных подгрупп заполняются предвнешние слои, а на внешнем слое остаётся чаще всего два электрона. У d-элементов заполняется предвнешний слой, а у f-элементов третий снаружи слой.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|