
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
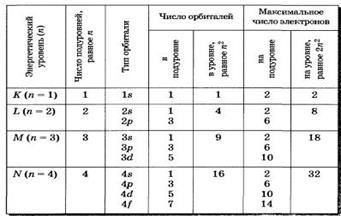
Тема: Строение атома. Квантовые числа.
Тема: Строение атома. Квантовые числа.
План:
1.Строение атома:
1.1 Ядерная модель атома.
1.2 Квантовые механические представления о строении атома
2.Квантовые числа:
2.1 Главное квантовое число
2.2 Орбитальное главное число
2.3 Магнитное и спиновое главные числа.
3.Принцип Паули
4.Строение атомых ядер. Изотопы.
1.
1.1
Первая попытка создания модели атома на основе накопленных экспериментальных данных принадлежит Дж. Томсону (1903 г.). Он считал, что атом представляет собой электронейтральную систему шарообразной формы радиусом примерно равным 10–10 м. Положительный заряд атома равномерно распределен по всему объему шара, а отрицательно заряженные электроны находятся внутри него (рис. 9.1.1). Для объяснения линейчатых спектров испускания атомов Томсон пытался определить расположение электронов в атоме и рассчитать частоты их колебаний около положений равновесия. Однако эти попытки не увенчались успехом. Через несколько лет в опытах великого английского физика Э. Резерфорда было доказано, что модель Томсона неверна.

Первые прямые эксперименты по исследованию внутренней структуры атомов были выполнены Э. Резерфордом и его сотрудниками Э. Марсденом и Х. Гейгером в 1909–1911 годах. Резерфорд предложил применить зондирование атома с помощью α-частиц, которые возникают при радиоактивном распаде радия и некоторых других элементов. Масса α-частиц приблизительно в 7300 раз больше массы электрона, а положительный заряд равен удвоенному элементарному заряду. В своих опытах Резерфорд использовал α-частицы с кинетической энергией около 5 МэВ (скорость таких частиц очень велика – порядка 107 м/с, но она все же значительно меньше скорости света). α-частицы – это полностью ионизированные атомы гелия. Они были открыты Резерфордом в 1899 году при изучении явления радиоактивности. Этими частицами Резерфорд бомбардировал атомы тяжелых элементов (золото, серебро, медь и др.). Электроны, входящие в состав атомов, вследствие малой массы не могут заметно изменить траекторию α-частицы. Рассеяние, то есть изменение направления движения α-частиц, может вызвать только тяжелая положительно заряженная часть атома. Схема опыта Резерфорда:
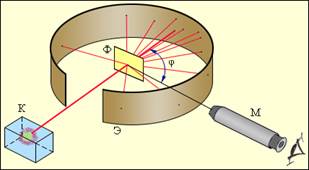
Схема опыта Резерфорда по рассеянию α-частиц. K – свинцовый контейнер с радиоактивным веществом, Э – экран, покрытый сернистым цинком, Ф – золотая фольга, M – микроскоп.
Он находился в резком противоречии с моделью атома Томсона, согласно которой положительный заряд распределен по всему объему атома. При таком распределении положительный заряд не может создать сильное электрическое поле, способное отбросить α-частицы назад. Электрическое поле однородного заряженного шара максимально на его поверхности и убывает до нуля по мере приближения к центру шара. Если бы радиус шара, в котором сосредоточен весь положительный заряд атома, уменьшился в n раз, то максимальная сила отталкивания, действующая на α-частицу по закону Кулона, возросла бы в n2 раз. Следовательно, при достаточно большом значении n α-частицы могли бы испытать рассеяние на большие углы вплоть до 180°. Эти соображения привели Резерфорда к выводу, что атом почти пустой, и весь его положительный заряд сосредоточен в малом объеме. Эту часть атома Резерфорд назвал атомным ядром. Так возникла ядерная модель атома. Рисунок иллюстрирует рассеяние α-частицы в атоме Томсона и в атоме Резерфорда.
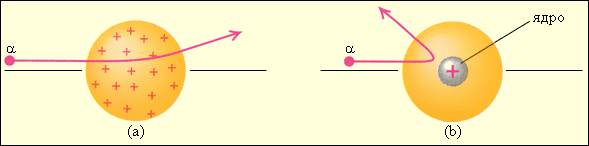
Таким образом, опыты Резерфорда и его сотрудников привели к выводу, что в центре атома находится плотное положительно заряженное ядро, диаметр которого не превышает 10–14–10–15 м. Это ядро занимает только 10–12 часть полного объема атома, но содержит весь положительный заряд и не менее 99,95 % его массы. Веществу, составляющему ядро атома, следовало приписать колоссальную плотность порядка ρ ≈ 1015 г/см3. Заряд ядра должен быть равен суммарному заряду всех электронов, входящих в состав атома. Впоследствии удалось установить, что если заряд электрона принять за единицу, то заряд ядра в точности равен номеру данного элемента в таблице Менделеева.
Радикальные выводы о строении атома, следовавшие из опытов Резерфорда, заставляли многих ученых сомневаться в их справедливости. Не исключением был и сам Резерфорд, опубликовавший результаты своих исследований только через два года (в 1911 г.) после выполнения первых экспериментов. Опираясь на классические представления о движении микрочастиц, Резерфорд предложил планетарную модель атома. Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно планетам, вращаются под действием кулоновских сил со стороны ядра электроны (рис. 9.1.4). Находиться в состоянии покоя электроны не могут, так как они упали бы на ядро.
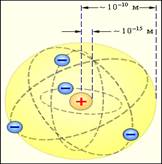
Планетарная модель атома, предложенная Резерфордом, несомненно явилась крупным шагом в развитии знаний о строении атома. Она была совершенно необходимой для объяснения опытов по рассеянию α-частиц. Однако она оказалась неспособной объяснить сам факт длительного существования атома, то есть его устойчивость. По законам классической электродинамики, движущийся с ускорением заряд должен излучать электромагнитные волны, уносящие энергию. За короткое время (порядка 10–8 с) все электроны в атоме Резерфорда должны растратить всю свою энергию и упасть на ядро. То, что этого не происходит в устойчивых состояниях атома, показывает, что внутренние процессы в атоме не подчиняются классическим законам.
Противоречия модели Резерфорда:
1.Не объясняет устойчивости атома: если частица движется, то она должна излучать электромагнитную энергию. Согласно классической электродинамике, заряженная частица, движущаяся с ускорением, непрерывно излучает электромагнитную энергию. Поэтому электроны, двигаясь вокруг ядра, т. е. ускоренно, должны были бы непрерывно терять энергию на излучение. Но при этом они за ничтожную долю секунды потеряли бы всю свою кинетическую энергию и упали бы на ядро.
2.Другая трудность, связанная также с излучением, состояла в следующем: если принять (в соответствии с классической электродинамикой), что частота излучаемого электроном света равна частоте колебаний электрона в атоме (т. е. числу оборотов, совершаемых им по своей орбите в одну секунду) или имеет кратное ей значение, то излучаемый свет по мере приближения электрона к ядру должен был бы непрерывно изменять свою частоту, и спектр излучаемого им света должен быть сплошным. Но это противоречит опыту. Т. о., в рамках модели атома Резерфорда не могли быть объяснены устойчивость атома по отношению к излучению и линейчатые спектры его излучения.
Атом излучает световые волны вполне определённых частот, типичных для данного химического элемента, и характеризуется спектром, состоящим из отдельных спектральных линий — линейчатым спектром.
Строение электронной оболочки атома по Бору. Как уже указывалось, в своей теории Нильс Бор исходил из ядерной модели атома. Основываясь на положении квантовой теории света о прерывистой, дискретной природе излучения и на линейчатом характере атомных спектров, он сделал вывод, что энергия электронов в атоме не может меняться непрерывно, а изменяется скачками, т. е. дискретно. Поэтому в атоме возможны не любые энергетические состояния электронов, а лишь определенные, «разрешенные» состояния. Иначе говоря, энергетические состояния электронов в атоме квантованы. Переход из одного разрешенного состояния в другое совершается скачкообразно и сопровождается испусканием или поглощением кванта электромагнитного излучения.
Основные положения своей теории Бор сформулировал в виде постулатов (постулат — утверждение, принимаемое без доказательства), содержание которых сводится к следующему:
1. Электрон может вращаться вокруг ядра не по любым, а только по некоторым определенным круговым орбитам. Эти орбиты получили название стационарных.
2. Двигаясь по стационарной орбите, электрон не излучает электромагнитной энергии.
3. Излучение происходит при скачкообразном переходе электрона с одной стационарной орбиты на другую. Прн этом испускается или поглощается квант электромагнитного излучения, энергия которого равна разности энергии атома в конечном и исходном состояниях.
Постулаты Бора находились в резком противоречии с положениями классической физики.
Теория Бора не только объяснила физическую природу атомных спектров как результата перехода атомных электронов с одних стационарных орбит на другие, но и впервые позволила рассчитывать спектры.
Бор не ограничился объяснением уже известных свойств спектра водорода, но на основе своей теории предсказал существование и местоположение неизвестных в то время спектральных серий водорода, находящихся в ультрафиолетовой и инфракрасной областях спектра и связанных с переходом электрона на ближайшую к ядру орбиту и на орбиты, более удаленные от ядра, чем вторая. Все эти спектральные серии были впоследствии экспериментально обнаружены в замечательном согласии с расчетами Бора.Расчет спектра атома водорода был блестящим успехом теории Бора.
Все же теория Бора была важным этапом в развитии представлений о строении атома; как и гипотеза Планка — Эйнштейна о световых квантах (фотонах), она показала, что нельзя автоматически распространять законы природы, справедливые для боль ших тел — объектов макромира, на ничтожно малые объекты микромира — атомы, электроны, фотоны. Поэтому и возникла задача разработки новой физической теории, пригодной для непротиворечивого описания свойств и поведения объектов микромира. При этом в случае макроскопических тел выводы этой теории должны совпадать с выводами классической механики и электродинамики (так называемый принцип соответствия, выдвинутый Бором).
Эта задача была решена в 20-х годах XX века, после возникновения и развития новой отрасли теоретической физики — квантовой или волновой механики.
1.2
Создание квантовой механики произошло на пути обобщения представления о корпускулярно-волновой двойственности фотона на все объекты микромира и, прежде всего, на электроны.
Корпускулярные свойства фотона выражаются уравнением Планка E = hv, согласно которому, фотон неделим и существует в виде дискретного образования. Волновые же свойства фотона находят выражение в уравнении: λv = с,связывающем длину волны λ электромагнитного колебания с его частотой v и скоростью распространения с. Использование здесь понятия о длине волны предполагает, что фотон обладает волновыми свойствами. Из этих уравнений получаем соотношение, связывающее корпускулярную характеристику фотона Е с его волновой характеристикой . В соответствии с уравнением Эйнштейна: Е = тс2.Из двух последних уравнений следует, что тс 2 = λv . Произведение массы тела на его скорость называется количеством движения тела, или его импульсом. Обозначая импульс фотона через р, окончательно получаем:E = h/р
Следует еще раз подчеркнуть, что полученное уравнение выведено, исходя из того, что фотону присущи как волновые, так и корпускулярные свойства.
Волновое уравнение было предложено в 1926 г. немецким физиком Э. Шрёдингером (1887-1961) для описания состояния электрона в атоме водорода. Он объединил математические выражения для колебательных процессов и уравнение де Бройля и получил следующее линейное дифференциальное однородное уравнение: 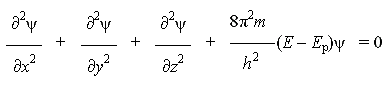
где ψ - волновая функция (аналог амплитуды для волнового движения в классической механике), которая характеризует движение электрона в пространстве как волнообразное возмущение; x, y, z - координаты, m - масса покоя электрона, h - постоянная Планка, E - полная энергия электрона, Ep - потенциальная энергия электрона.
Решениями уравнения Шрёдингера являются волновые функции. Для одноэлектронной системы (атома водорода) выражение для потенциальной энергии электрона имеет простой вид:
Ep = −e2 / r,
где e - заряд электрона, r - расстояние от электрона до ядра. В этом случае уравнение Шрёдингера имеет точное решение.

Чтобы решить волновое уравнение, надо разделить его переменные. Для этого заменяют декартовы координаты x, y, z на сферические r, θ, φ. Тогда волновую функцию можно представить в виде произведения трех функций, каждая из которых содержит только одну переменную:
ψ(x,y,z) = R(r) Θ(θ) Φ(φ)
Функцию R(r) называют радиальной составляющей волновой функции, а Θ(θ) Φ(φ) - ее угловыми составляющими.
Мы знаем, однако, что представление об электроне как о материальной точке не соответствует его истинной физической природе. Поэтому правильнее рассматривать как схематическое изображение электрона, «размазанного» по всему объему атома в виде так называемого электронного облака: чем плотнее расположены точки в том или ином месте, тем больше здесь плотность электронного облака. Иначе говоря, плотность электронного облака пропорциональна квадрату волновой функции . Геометрическим образом одноэлектронной волновой функции является атомная орбиталь. Она представляет собой область пространства вокруг ядра атома, в которой высока вероятность обнаружения электрона (обычно выбирают значение вероятности 90-95%). Это слово происходит от латинского "орбита" (путь, колея), но имеет другой смысл, не совпадающий с понятием траектории (пути) электрона вокруг атома, предложенным Н. Бором для планетарной модели атома. Контуры атомной орбитали - это графическое отображение волновой функции, полученной при решении волнового уравнения для одного электрона.
В ходе решения волнового уравнения вводятся целые числа - так называемые квантовые числа (главное n, орбитальное l и магнитное ml). Функция R(r) зависит от n и l, функция Θ(θ) - от l и ml, функция Φ(φ) - от ml.
2.
Квантовые числа, возникающие при решении волнового уравнения, служат для описания состояний квантово-химической системы. Каждая атомная орбиталь характеризуется набором из трех квантовых чисел: главного n, орбитального l и магнитного ml.
 Главное квантовое число n характеризует энергию атомной орбитали. Оно может принимать любые положительные целочисленные значения. Чем больше значение n, тем выше энергия и больше размер орбитали. Решение уравнения Шрёдингера для атома водорода дает следующее выражение для энергии электрона:
Главное квантовое число n характеризует энергию атомной орбитали. Оно может принимать любые положительные целочисленные значения. Чем больше значение n, тем выше энергия и больше размер орбитали. Решение уравнения Шрёдингера для атома водорода дает следующее выражение для энергии электрона:
E = −2π2me4 / n2h2 = −1312,1 / n2 (кДж/моль)
Таким образом, каждому значению главного квантового числа отвечает определенное значение энергии электрона. Уровни энергии с определенными значениями n иногда обозначают буквами K, L, M, N... (для n = 1, 2, 3, 4...).
Орбитальное квантовое число l характеризует энергетический подуровень. Атомные орбитали с разными орбитальными квантовыми числами различаются энергией и формой. Для каждого n разрешены целочисленные значения l от 0 до (n−1). Значения l = 0, 1, 2, 3... соответствуют энергетическим подуровням s, p, d, f.
Форма s-орбиталей сферическая, p-орбитали напоминают гантели, d- и f-орбитали имеют более сложную форму.
 Магнитное квантовое число ml отвечает за ориентацию атомных орбиталей в пространстве. Для каждого значения l магнитное квантовое число ml может принимать целочисленные значения от −l до +l (всего 2l + 1 значений). Например, р-орбитали (l = 1) могут быть ориентированы тремя способами (ml = -1, 0, +1).
Магнитное квантовое число ml отвечает за ориентацию атомных орбиталей в пространстве. Для каждого значения l магнитное квантовое число ml может принимать целочисленные значения от −l до +l (всего 2l + 1 значений). Например, р-орбитали (l = 1) могут быть ориентированы тремя способами (ml = -1, 0, +1).
Электрон, занимающий определенную орбиталь, характеризуется тремя квантовыми числами, описывающими эту орбиталь и четвертым квантовым числом (спиновым) ms, которое характеризует спин электрона - одно из свойств (наряду с массой и зарядом) этой элементарной частицы. Спин - собственный магнитный момент количества движения элементарной частицы. Хотя это слово по-английски означает "вращение", спин не связан с каким-либо перемещением частицы, а имеет квантовую природу. Спин электрона характеризуется спиновым квантовым числом ms, которое может быть равно +1/2 и −1/2.
3.
Точное решение уравнения Шредингера удается найти лишь в редких случаях, например, для атома водорода и гипотетических одноэлектронных ионов, таких как He+, Li2+, Be3+. Атом следующего за водородом элемента - гелия - состоит из ядра и двух электронов, каждый из которых притягивается к обоим ядрам и отталкивается от другого электрона. Уже в этом случае волновое уравнение не имеет точного решения.
Поэтому большое значение имеют различные приближенные методы. С помощью таких методов удалось установить электронное строение атомов всех известных элементов. Эти расчеты показывают, что орбитали в многоэлектронных атомах не сильно отличаются от орбиталей атома водорода (эти орбитали называют водородоподобными). Главное отличие - некоторая сжатость орбиталей из-за большего заряда ядра. Кроме того, для многоэлектронных атомов найдено, что для каждого энергетического уровня (при данном значении главного квантового числа n) происходит расщепление на подуровни. Энергия электрона зависит уже не только от n, но и от орбитального квантового числа l. Она увеличивается в ряду s-, p-, d-, f-орбиталей Для высоких энергетических уровней различия в энергиях подуровней достаточно велики, так что один уровень может проникать в другой, например
6s < 5d  4f < 6p.
4f < 6p.
Заселение атомных орбиталей для многоэлектронного атома в основном (то есть энергетически наиболее выгодном) состоянии происходит в соответствии с определенными правилами.
Последовательность заполнения атомных электронных орбита-лей в зависимости от значений главного и орбитального квантовых чисел была исследована советским ученым В. М. Клечков-ским, который установил, что энергия электрона возрастает по мере увеличения суммы этих двух квантовых чисел, т. е. величины (п + /). В соответствии с этим, им было сформулировано следующее положение (первое правило Клечковского): при увеличении заряда ядра атома последовательное заполнение электронных орбиталей происходит от орбиталей с меньшим значением суммы главного и орбитального квантовых чисел (п + /) к орби-талям с большим значением этой суммы.
Электронное строение атомов калия и кальция соответствует этому правилу. Действительно, для Зе^-орбиталей (п = 3, 1 — 2) сумма (п + /) равна 5, а для 45-орбитали (п = 4, 1 = 0)—равна 4. Следовательно, 45-подуровень должен заполняться раньше, чем подуровень 3d, что в действительности п происходит.
Принцип минимума энергии определяет порядок заселения атомных орбиталей, имеющих различные энергии. Согласно принципу минимума энергии, электроны занимают в первую очередь орбитали, имеющие наименьшую энергию. Энергия подуровней растет в ряду:
1s < 2s < 2 p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f  5d < 6p < 7s < 5f
5d < 6p < 7s < 5f  6d...
6d...
Атом водорода имеет один электрон, который может находиться на любой орбитали. Однако, в основном состоянии он должен занимать 1s-орбиталь, имеющую самую низкую энергию.
В атоме калия последний девятнадцатый электрон может заселить либо 3d-, либо 4s-орбиталь. В соответствии с принципом минимума энергии, электрон занимает 4s-орбиталь, что подтверждается экспериментом.
Следует обратить внимание на неопределенность записи 4f 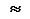 5d и 5f
5d и 5f 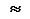 6d. Оказалось, что у одних элементов более низкую энергию имеет 4f-подуровень, а у других - 5d-подуровень. То же самое наблюдается для 5f- и 6d-подуровней.
6d. Оказалось, что у одних элементов более низкую энергию имеет 4f-подуровень, а у других - 5d-подуровень. То же самое наблюдается для 5f- и 6d-подуровней.
Второе правило Клечковскогогласит: при одинаковых значениях суммы («+/) заполнение орбиталей, происхдит последовательно в направлении возрастания значения главного квантового числа п.
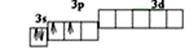
Принцип Паули, который часто называют еще принципом запрета, ограничивает число электронов, которые могут находиться на одной орбитали. Согласно принципу Паули, на любой орбитали может находиться не более двух электронов и то лишь в том случае, если они имеют противоположные спины (неодинаковые спиновые числа). Поэтому в атоме не должно быть двух электронов с одинаковыми четырьмя квантовыми числами (n, l, ml, ms).
Атом лития имеет три электрона. Орбиталь с самой низкой энергией - 1s-орбиталь - может быть заселена лишь двумя электронами, причем у этих электронов должны быть разные спины. Если обозначать спин +1/2 стрелкой, направленной вверх, а спин −1/2 - стрелкой, направленной вниз, то два электрона с противоположными (антипараллельными) спинами на одной орбитали можно схематически представить так:
Правило Гунда (Хунда) определяет порядок заселения электронами орбиталей, имеющих одинаковую энергию. Оно было выведено немецким физиком-теоретиком Ф. Хундом в 1927 г. на основе анализа атомных спектров.
Согласно правилу Гунда, заселение орбиталей, относящихся к одному и тому же энергетическому подуровню, начинается одиночными электронами с параллельными (одинаковыми по знаку) спинами, и лишь после того, как одиночные электроны займут все орбитали, может происходить окончательное заселение орбиталей парами электронов с противоположными спинами. В результате суммарный спин (и сумма спиновых квантовых чисел) всех электронов в атоме будет максимальным.
4.
Идея о строении атомных ядер из протонов и нейтронов вскоре после открытия нейтрона была высказана советским физиком Дмитрием Дмитриевичем Иваненко (р. 1904) и немецким физиком Вернером Гейзенбергом (1901 —1976). Справедливость протонно-нейтронной модели ядра была доказана работами ряда ученых.
Поскольку массовое число протона и нейтрона есть единица, массовое число ядра равно полному числу частиц (протонов и нейтронов) в составе ядра. Заряд же ядра, выраженный в элементарных единицах, равен, очевидно, числу протонов в ядре. Таким образом, согласно протонно-нейтронной модели, атомное ядро с массовым числом A и зарядом Z содержит в своем составе А частиц, в том числе Z протонов и А—Z нейтронов. Так, например, ядро кислорода 168О состоит из 8 протонов и 16—8=8 нейтронов. Ядро изотопа свинца 20682Pb содержит 82 протона и 206—82=124 нейтрона и т. д.
Простейшим атомным ядром является ядро водорода, т. е. протон. Присоединяя к протону нейтрон, получим самое простое из составных ядер — дейтрон, или ядро тяжелого водорода (обозначается 21Н или D).
Прибавляя еще один нейтрон, образуем ядро еще более тяжелого изотопа водорода, называемого тритием (31Н, или Т). Тритий относится к числу искусственно-радиоактивных веществ; он распадается с периодом полураспада около 12 лет, испуская электроны. В результате распада трития образуется ядро с массовым числом 3 и зарядом 2 — легкий изотоп гелия 32Не, состоящий из двух протонов и нейтрона. Этот изотоп устойчив и содержится в очень малой пропорции в природном гелии. Ядро основного изотопа гелия |Не (a-частица) образуется добавлением еще одного нейтрона, a-частица содержит, таким образом, два протона и два нейтрона.

Продолжая увеличивать число нейтронов и протонов в ядре, мы получим все существующие атомные ядра. Поскольку ядерные частицы — протоны и нейтроны — прочно удерживаются в ядрах, между ними должны действовать силы притяжения. Эти силы должны быть достаточно велики, чтобы противостоять грандиозным силам взаимного электростатического отталкивания протонов, сближенных на расстояние порядка размеров ядра (10-14— 10-15 м). Особые силы, возникающие при сближении ядерных частиц (протонов, нейтронов) на малые расстояния и связывающие эти частицы в ядра, получили название ядерных сил.
Изотопы — атомы хим. элемента, обладающие разными массовыми числами, но имеющие одинаковый заряд атомных ядер и поэтому занимающие одно место в периодической системе Менделеева.
Радиоактивность (от лат. radio — излучаю, radius — луч и activus — действенный), самопроизвольное (спонтанное) превращение неустойчивого изотопа химического элемента в другой изотоп (обычно — изотоп другого элемента).
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|