
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ЕН.01 Химия. Теоретические основы. Задачи на определение массы веществ в растворе. Задачи на определение массовой доли веществ в растворе
ЕН.01 Химия
Тема: Концентрация растворов.
Цель: Формирование базовых знаний о способах определения свойств и концентраций растворов и навыков проведения расчетов.
Теоретические основы
Массовая доля (w%), процентная концентрация (С%) – показывает сколько единиц массы вещества растворено в 100 единицах массы раствора (количество грамм растворенного вещества в 100 граммах раствора).
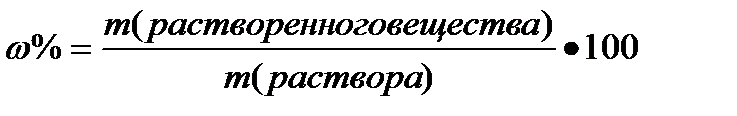 %
% 

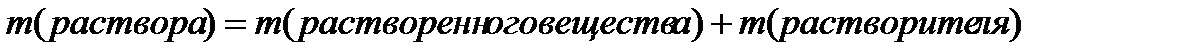
m (растворителя) = m(раствора)- m (растворенного вещества)
 ,
,
где V – объем раствора, P- плотность раствора.
Нахождение массы растворенного вещества:

1. Задачи на определение массы веществ в растворе
Какую массу соли и объем воды необходимо взять для приготовления50 г 0,5 %-ного раствора (ответ: 0,25 г, H2O - 49,75 мл);
Решение задачи:
m (р-ра) = 50 г
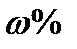 (соли) = 0,005 (соли) = 0,005
| m (соли) = 50 г · 0,005 = 0,25 г соли m (H2O) = 50 г - 0,25 г = 49,75 г V (H2O) = 49,75 г ? 1 г/мл = 49,75 Ответ: m (соли) = 0,25 г |
2. Задачи на определение массы веществ, необходимой для получения раствора нужной концентрации:
Какую массу соли надо добавить к 200 мл воды, чтобы получить 3 %-ный раствор?
Ответ: 6,2 г;
Решение задачи:
V(Н2О) = 200 мл 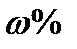 (соли)= 0,03 (3 %)
m (соли) = ? (соли)= 0,03 (3 %)
m (соли) = ?
| 1) 3 %-ный раствор – это на 100 г р-ра – 3 г соли и 97 г воды2) m (200 мл Н2О) = 200 мл · 1 г/мл = 200 г3) m (соли) = ?3 г соли – на 97 г Н2Ох - 200 г Н2О3 х 200х = ---------- = 6,2 г.97Ответ: m (соли) = 6,2 г |
3. Задачи на определение массовой доли веществ в растворе
Смешали гидроксид натрия NaOH в количестве 1 моль с 1 л воды. Какова массовая доля гидроксида натрия в полученном растворе? Ответ: 0,038;
Решение задачи:
n(NaOH) = 1 мольV(Н2О) = 1 л
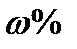 (NaOH) = ? (NaOH) = ?
| m(NaOH) = 1 моль х 40 г/моль = 40 гm (H2O) = 1000 мл х 1 г/мл = 1000 гm (р-ра) = 1000 г + 40 г = 1040 г40 г 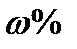 (NaOH) = ------ = 0,038 (3,8 %)1040 гОтвет: (NaOH) = ------ = 0,038 (3,8 %)1040 гОтвет: 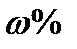 (NaOH) = 0,038 (3,8 %) (NaOH) = 0,038 (3,8 %)
|
Решите задачи
1. 60 г 1 %-ного раствора (ответ: 0,6 г, H2O - 59,4 мл);
2. Какую массу соли надо добавить к 120 мл воды, чтобы получить 1 %-ный раствор? Ответ: 1,21 г;
3. Смешали 5 г сахара и 150 мл воды. Какова массовая доля сахара в полученном растворе? Ответ: 0,032.;
Контрольные вопросы:
1. Что такое раствор и растворитель?
2. Как определяется процентная концентрация раствора?
Сформулируйте вывод по работе.
Оценка выполненной работы: 2 балла
| Критерий оценки | Балл |
| Работа не выполнена | |
| Работа выполнена не в полном объеме | |
| Работа выполнена в полном объеме, без ошибок |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|