
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Синтез АУЭ
Теоретическая часть курсовой работы
Ацетоуксусный эфир и синтезы на его основе
Ацетоуксусный эфир — органическое соединение из класса сложных эфиров, этиловый эфир ацетоуксусной C4H6O3 кислоты. Специалисты это вещество называют еще этил-3-оксобутаноатом, этил-3-оксобутиратом, этиловый эфир ацетоуксусной кислоты, диуксусным эфиром, этилацетилацетонатом.
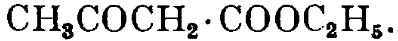
Впервые получен Гейтером в 1863 г. Ацетоуксусный эфир готовится в медных аппаратах растворением металлического натрия в совершенно сухом, тщательно очищенном уксусном эфире. После того как пройдет бурная реакция и растворится весь натрий, содержимое аппарата переводится в разбавленную (50%-ную) уксусную кислоту, взятую в количестве, обеспечивающем кислую реакцию после прибавления всей реакционной смеси. Водный раствор уксуснонатриевой соли спускают, а ацетоуксусный эфир, содержащий избыток уксусного эфира, подвергают перегонке. Фракция ацетоуксусного эфира перегоняется предпочтительно в вакууме.
| Физические свойства | |
| Состояние | бесцветная жидкость с фруктовым запахом |
| Молярная масса | 130,1418 ± 0,0064 г/моль |
| Плотность | 1,0284 г/см³ |
| Температура плавления | -45 °C |
| Температура кипения | 180,8 °C |
| Показатель преломления | 1,4198 |
Строение и химические свойства ацетоуксусного эфира
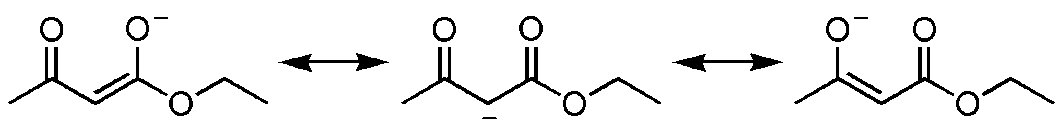
Практически все карбонильные соединения существуют в виде таутомерных смесей кетонной и енольной форм. Ацетоуксусный эфир - равновесная смесь двух таутомерных форм этилового эфира b-оксикротоновой кислоты - енольная форма (I) и этилового эфира ацетоуксусной кислоты - кетонная форма (II): 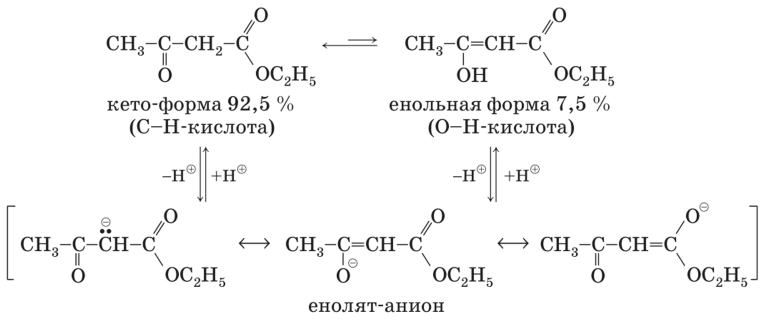
Взаимные переходы кетонной и енольной форм происходят через образование резонансно стабилизированного аниона (енолят-иона) и не требуют больших энергетических затрат. Энергия активации таких переходов не превышает 8 кДж/моль, что существенно ниже энергии активации для большинства химических реакций ацетоуксусного эфира.
Таутомерные формы АУЭ получены в индивидуальном виде. Кето-форма выкристаллизовывается при охлаждении растворов ацетоуксусного эфира до температуры -78 °С (Л. Кнорр, 1911 г.). Енольная форма (как менее полярная и более летучая) отгоняется при перегонке эфира в кварцевой посуде (К. Мейер, 1911 г.). Наличие таутомерных форм было подтверждено также с помощью спектроскопических методов.
Енольная форма термодинамически менее стабильна, чем кетонная, а сам процесс образования енольной формы — эндотермичен. Однако, как было показано выше, содержание енольной формы в таутомерной смеси сухого АУЭ довольно велико, а именно 7,5 % . Это обусловлено двумя причинами: а) наличием двух ЭА-заместителей у С-Н-кислотного атома углерода; б) стабилизацией енольной формы за счет образования шестичленного цикла с помощью внутримолекулярной водородной связи:
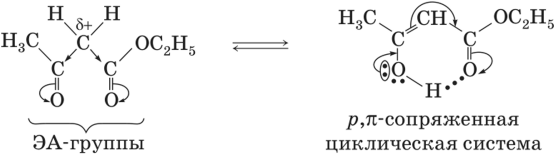
На положение кето-енольного равновесия влияет полярность растворителя. Енольная форма АУЭ менее полярна, а потому слабее сольватируется полярными растворителями, чем кетонная. В водной среде содержание енольной формы минимально (менее 1 %), так как в воде разрушаются внутримолекулярные водородные связи циклическая система. В неполярных растворителях содержание енола в таутомерной смеси резко возрастает и может превышать 40 % .
Кетонная форма ацетоуксусного эфира может быть выделена из равновесной смеси вымораживанием, енольная - вакуумной перегонкой в кварцевой посуде. Скорость установления кето-енольного равновесия зависит от температуры и материала сосуда, чистые таутомеры хранятся в кварцевой посуде при низких температурах (-80°C - охлаждение сухим льдом).
Содержание енольной формы определяется бромометрически: бром практически мгновенно присоединяется по двойной связи енола, что сопровождается исчезновением желто-оранжевой окраски молекулярного брома.
Реакциями енольной формы также обусловлено O-ацилирование ацетоуксусного эфира хлорангидридами карбоновых кислот в пиридине, при этом образуются сложные эфиры β-гидроксикротоновой кислоты:
CH3(HO)C=CHCOOC2H5 + ROCl  CH3(ROO)C=CHCOOC2H5 + HCl
CH3(ROO)C=CHCOOC2H5 + HCl
При взаимодействии с пентахлоридом фосфора гидроксил енольной формы ацетоуксусного эфира замещается на хлор с образованием этилового эфира β-хлоркротоновой кислоты:
CH3(HO)C=CHCOOC2H5 + PCl5  CH3ClC=CHCOOC2H5 + POCl3 + HCl
CH3ClC=CHCOOC2H5 + POCl3 + HCl
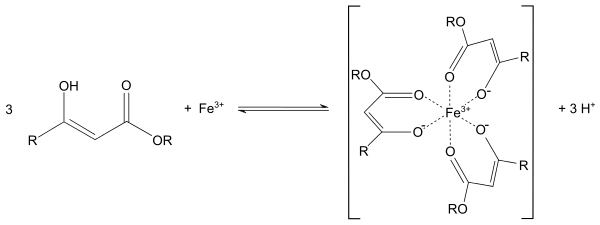
С металлами ацетоуксусный эфир образует хелаты, в которых ацетилацетат-анион выступает в роли бидентантного лиганда, так, с солями трехвалентного железа ацетоуксусный эфир образует окрашенный в пурпурный цвет комплекс:
Под действием сильных оснований и щелочных металлов ацетоуксусный эфир депротонируется с образованием резонансно стабилизированного аниона:
Образование натриевой соли ацетилацетата (натрийацетоуксусного эфира) под действием алкоголята натрия - в том числе и под действием этилата натрия, образующегося in situ при действии металлического натрия на ацетоуксусный эфир - широко используется в синтетической практике вследствие высокой нуклеофильности аниона.
Ацетилацетат натрия в реакциях с мягкими электрофилами выступает в роли C-нуклеофила. Так, он легко алкилируется галогеналкилами с образованием соответствующих алкилацетоуксусных эфиров, из которых, в свою очередь, могут быть получены и затем проалкилированы натриевые производные:
CH3COCH2COOC2H5 + EtONa  CH3COCH-COOC2H5 Na+ + EtOH
CH3COCH-COOC2H5 Na+ + EtOH
CH3COCH-COOC2H5 Na+ + RHal 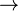 CH3COCHRCOOC2H5 + NaHal
CH3COCHRCOOC2H5 + NaHal
В безводных условиях в присутствии бикарбоната натрия ацетоуксусный эфир самоконденсируется с образованием дегидроацетовой кислоты:
2 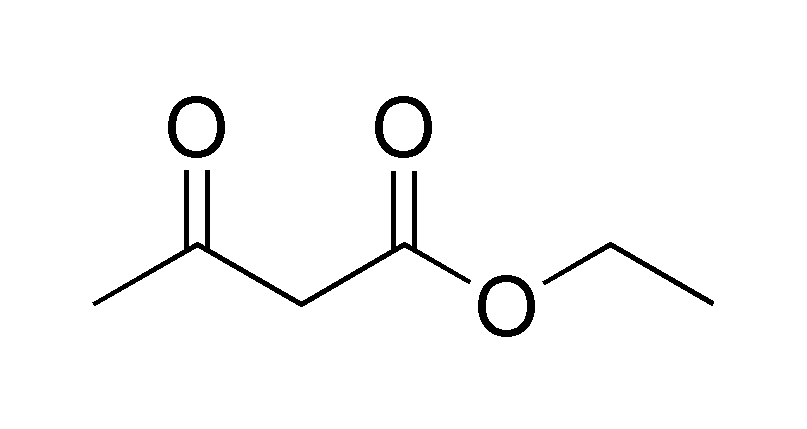
| → 
|
Под действием серной кислоты на ацетоуксусный эфир происходит самоконденсация двух молекул эфира с замыканием α-пиронового цикла, ведущая к образованию изодегидроацетовой кислоты
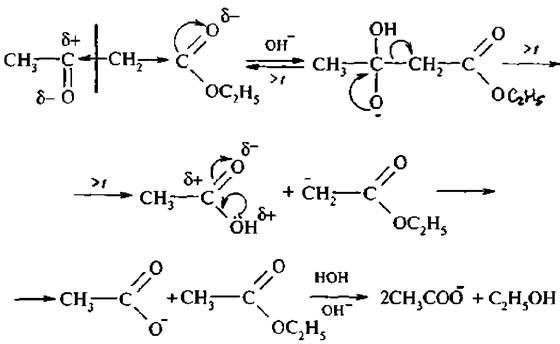
Под действием водных кислот или разбавленных растворов щелочей ацетоуксусный эфир омыляется с образованием нестабильной ацетоуксусной кислоты, которая в мягких условиях декарбоксилируется с образованием ацетона:
CH3COCH2COOC2H5 + H2O 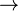 CH3COCH2COOH + C2H5OH
CH3COCH2COOH + C2H5OH
CH3COCH2COOH 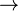 CH3COCH3 + CO2 + H2O
CH3COCH3 + CO2 + H2O
Аналогичным образом ведут себя и моно- и дизамещенные ацетоуксусные эфиры, полученные алкилированием натрийацетоуксусного эфира (кетонное расщепление), эта реакция используется для синтеза замещенных метилкетонов.
Иначе протекает взаимодействие ацетоуксусного эфира с концентрированными растворами щелочей: в этом случае протекает отщепление ацетильной группы с образованием двух молекул уксусной кислоты (кислотное расщепление), эта реакция идет и с замещенными ацетоуксусными эфирами и используется для синтеза гомологов уксусной кислоты через алкилпроизводные ацетоуксусного эфира:
CH3COCHRCOOC2H5 + OH- + H2O 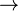 CH3COO- + RCH2COOH + C2H5OH
CH3COO- + RCH2COOH + C2H5OH
Синтез АУЭ
Классическим методом синтеза ацетоуксусного эфира является сложноэфирная конденсация этилацетата в присутствии этанола под действием металлического натрия, катализатором конденсации является образующийся in situ этилат натрия. Образующийся натрийацетоуксусный эфир действием разбавленной минеральной кислоты переводят в ацетоуксусный эфир:
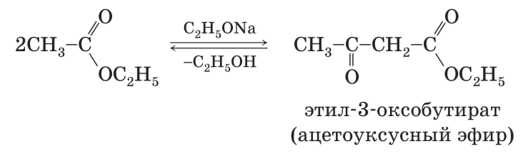
Ацетоуксусный эфир также может быть синтезирован ацилированием этанола дикетеном, этот метод является промышленным методом синтеза:
Синтезы на основе ацетоуксусного эфира
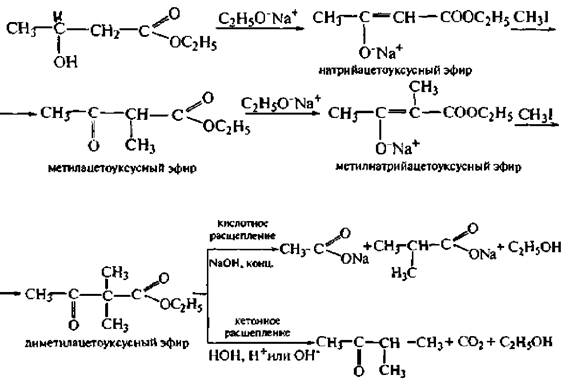
При решении таких синтетических задач две первые стадии химической модификации АУЭ одинаковы, а именно: а) активация АУЭ сильным основанием; б) С-алкилирование Na-АУЭ (одна или две стадии алкилирования).
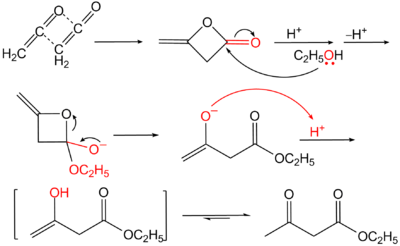
Далее для получения несимметричных кетонов осуществляют гидролиз сложноэфирной группы и декарбоксилирование образовавшейся алкил- или диалкилацетоуксусной кислоты (схема кетонного расщепления).
Для получения карбоновых кислот алкильные производные АУЭ подвергают кислотному расщеплению под действием концентрированных растворов щелочей, в результате чего образуются соответствующие моно- или диалкилуксусные кислоты
Основной задачей при планировании синтеза кетонов или карбоновых кислот на основе АУЭ является правильный выбор алкилирующего агента.
При этом следует помнить, что
• в результате кетонного расщепления в образовавшемся кетоне сохраняется фрагмент ацетона;
• в результате кислотного расщепления молекула образовавшейся карбоновой кислоты содержит фрагмент уксусной кислоты.
В качестве алкилирующих агентов могут быть использованы многие другие классы соединений: хлоро- или бромопроизводные кетонов (С1СН2СОСН3) или сложных эфиров (ВгСН2СООС2Н5), дигалогеноалканы, галогенопроизводные аллильного или бензильного типа и др.
Для ацетоуксусного эфира характерно два типа расщеплений: кетонное и кислотное.
В этих условиях происходит гидролиз по сложноэфирной группе, образуется ацетоуксусная кислота, которая декарбоксилируется с образованием кетона.
Кислотное расшепление протекает под влиянием концентрированных растворов щелочей.
Ацетоуксусный эфир широко применяется для получения различных кетонов или кислот, например:
Меры предосторожности
Соединение относится к 3-му классу опасности для человека (умеренно опасно). Легковоспламеняющееся вещество. Вызывает раздражение при контакте с кожей и ее покраснение, опасно для глаз. Пары вызывают кашель и жжение в горле.
Хранят этилацетоацетат в прохладных помещениях, на защищенных от света складах, в герметично закрытых емкостях. Следует строго следить за целостностью тары. Нельзя хранить реактив в одном помещении с горючими веществами, сильными окислителями, щелочами и кислотами, щелочными металлами.
Применение
•В химпроме — для органического синтеза кетонов, дикетонов, метилкетонов, уксусной кислоты и ее производных, других карбоновых кислот, производных пиридина, гетероцикличных соединений, порфиринов.
• Для производства красителей. В их числе пиразолоновые красители и пигменты (для текстильпрома), отличающиеся светостойкостью и прочностью, а также чернила, лаки, желтые краски, пластик.
• Для изготовления гербицидов и феромонов насекомых, используемых для защиты растений в сельском хозяйстве.
• Используется как вспомогательная среда в процессах синтеза шовных материалов для хирургии, биоразлагаемых полимеров, ветеринарных биорегуляторов, антиоксидантов для пищепрома.
• В фармацевтике — для изготовления лекарственных средств (антибиотиков, противомалярийных препаратов, анальгетиков, аминокислот, например, анальгина, пирамидона, амидопирина, антипирина, акрихина, витамина В1).
• В фотоделе для получения желтой составляющей при проявлении цветных фотографий.
• Для получения ароматизаторов в пищепроме.
• При изготовлении парфюмерной продукции.
• В качестве полярного растворителя в лабораторной практике.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|