
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Карбоновые кислоты
Карбоновые кислоты
Карбоновыми кислотами называются органические соединения, в молекуле которых содержится одна или несколько карбоксильных групп – СООН.
Карбоновые кислоты давно известны человеку, но изучены они относительно недавно. В 70-х гг. 20 века было известно 170 карбоновых кислот, в настоящее время – более 300.
Карбоновые кислоты широко распространены в природе. Например, метановая, или муравьиная кислота, содержится в выделениях муравьёв. Изовалериановая кислота содержится в корнях валерианы лекарственной, бензойная кислота встречается в бруснике, клюкве, чернике, щавелевая кислота содержится в листьях щавеля и ревеня, малоновая кислота есть в соке сахарной свёклы. Янтарная кислоты выделена из продуктов сухой перегонки янтаря. Очень много яблочной кислоты в ягодах и фруктах, а лимонная кислота содержится во многих растениях, в лимонном соке её массовая доля 10 %.
Существует несколько классификаций карбоновых кислот. Так, в зависимости от строения углеводородной цепи различают алифатические карбоновые кислоты, алициклические и ароматические.
Среди алифатических карбоновых кислот различают насыщенные карбоновые кислоты, например, пропановая кислота, и ненасыщенные карбоновые кислоты, например, пропеновая кислота.
К алициклическим карбоновым кислотам относятся кислоты, в молекулах которых есть цикл, например, циклогексанкарбоновая кислота. К ароматическим кислотам относятся кислоты, в молекулах которых есть ароматическое кольцо, например, бензойная кислота.
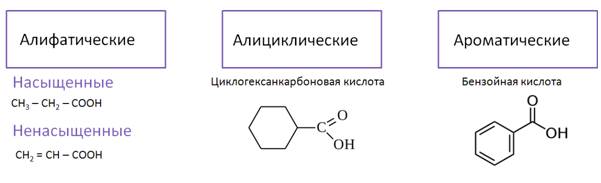
По числу карбоксильных групп различают монокарбоновые кислоты, или одноосновные, которые содержат одну карбоксильную группу, как например, этановая кислота. Кроме монокарбоновых кислот есть ещё и дикарбоновые, или двухосновные, в молекулах которых две карбоксильные группы, например в бензол-1,4-дикарбоновой кислоте.
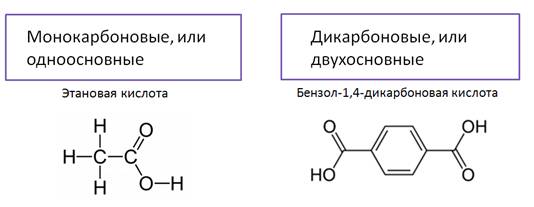
Карбоновые кислоты содержат в молекуле только одну карбоксильную группу. Их состав выражается общей формулой CnH2n+1COOH, или R – OH, где R – алкильная группа. Кроме этого, можно использовать ещё одну общую формулу, которая отражает молекулярный состав кислот – это CnH2nO2.
Функциональная группа карбоновых кислот – СООН, называется карбоксильной, так как состоит из карбонильной группы – С = О и гидроксильной – ОН группы.
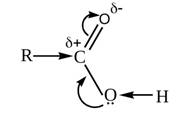
Строение карбоксильной группы определяет свойства карбоновых кислот. В карбоксильной группе электронная плотность смещена к атому кислорода, из-за чего на атоме углерода в этой группе возникает частичный положительный заряд. Компенсация возникающего положительного заряда происходит за счёт смещения электронов неподелённой пары атома кислорода в гидроксильной группе. Поэтому в гидроксильной группе происходит смещение электронной плотности к атому кислорода. Связь между кислородом и водородом в гидроксильной группе становится более полярной, поэтому атом водорода становится ещё более подвижным, чем у спиртов.
Рассмотрим гомологический ряд насыщенных одноосновных карбоновых кислот. Первый представитель этого ряда метановая кислота, или муравьиная, вторая кислота в гомологическом ряду – этановая, или уксусная, третья – пропановая, или пропионовая, четвёртая – бутановая, или масляная кислота, пятая кислота – пентановая, или валериановая, шестая – гексановая, или капроновая.
По правилам номенклатуры ИЮПАК названия карбоновых кислот образуются добавлением суффикса -овая- и слова «кислота» к названию соответствующего алкана. Нумерацию начинают с атома углерода при карбоксильной группе. Затем указывают положение заместителей в алфавитном порядке. Назовём кислоты с разветвлённой цепью. В первой кислоте 5 атомов углерода в основной цепи, от второго атома углерода отходит заместитель этил, а от третьего – заместитель метил. Поэтому название кислоты будет 3-метил-2-этилпентановая кислота. У второй кислоты главная цепь состоит из пяти атомов углерода. От второго атома углерода отходит заместитель этил. Поэтому название этой кислоты буде 2-этилпентановая кислота.
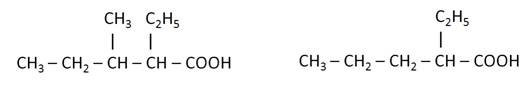
Для насыщенных одноосновных карбоновых кислот характерна изомерия углеродного скелета и межклассовая со сложными эфирами. Первые три представителя карбоновых кислот изомеров не имеют. Для кислоты состава С4Н8О2 возможны следующие изомеры: бутановая кислота и 2-метилпропановая кислота. Межклассовыми изомерами будут метиловый эфир пропановой кислоты, этиловый эфир уксусной кислоты, пропиловый эфир муравьиной кислоты, изопропиловый эфир муравьиной кислоты.

Простейшим представителем ненасыщенных одноосновных карбоновых кислот является пропеновая кислота, тривиальное название этой кислоты акриловая: CH2 = CН – СООН
К высшим ненасыщенным одноосновным карбоновым кислотам относится олеиновая кислота – С17Н33COOH, у которой двойная связь находится между 9 и 10 атомами углерода:
СН3 – (СН2)7 – СН = СН – (СН2)7 – СООН
К высшим ненасыщенным кислотам, которые содержат две и более кратные связи, относятся линолевая кислота – С17Н31СООН и линоленовая кислота – С17Н29СООН. В молекуле линолевой кислоты содержится две двойные связи, а в линоленовой кислоте три двойные связи.
СН3 – (СН2)4 – СН = СН – СН2 – СН = СН – (СН2)7 – СООН
Октадекадиен-9,12-овая кислота
СН3 – СН2 – СН = СН – СН2 – СН = СН – СН2 – СН = СН – (СН2)7 – СООН Октадекатриен-9,12,15-овая кислота
Сорбиновая кислота также является ненасыщенной одноосновной кислотой. В составе этой кислоты две двойные связи.
СН3 – СН = СН – СН = СН – СООН
В природе сорбиновая кислота встречается в некоторых растениях, она выделена в середине 19 века.
Среди высших насыщенных карбоновых кислот наиболее распространены пальмитиновая кислота – С15Н31СООН и стеариновая кислоты – С17Н35СООН. Их называют ещё высшими жирными кислотами, так как их природным источником являются жиры. Так, пальмитиновую кислоту получают из пальмового масла, содержащегося в кокосе.
Карбоновые кислоты имеют широкое применение. Муравьиная кислота применяется в текстильной промышленности как протрава при крашении, а также в кожевенной промышленности (дубление кож), для получения щавелевой кислоты, для получения лекарственных средств, средств защиты растений, в качестве растворителя и консерванта.
Уксусная кислота используется в качестве столового уксуса, её используют для получения искусственных волокон, в производстве ацетатов, лекарственных средств (аспирина), а также красителей и лаков. Уксусная кислота – хороший растворитель для многих органических соединений. Её используют для получения ядохимикатов, кино- и фотоплёнок.
Высшие карбоновые кислоты применяются для производства мыла.
Акриловая кислота и её гомологи используется для получения органического стекла, синтетических волокон, как например, нитрон.
Олеиновая кислота применяется в производстве мыла, для обработки шерсти в текстильной промышленности, для изготовления типографических красок.
Сорбиновую кислоту используют в пищевой промышленности, в качестве консервирующего средства.
Таким образом, карбоновые кислоты содержат карбоксильную группу – СООН. Карбоновые кислоты классифицируют в зависимости от строения углеводородной цепи и по числу карбоксильных групп. Химический состав одноосновных кислот выражается общей формулой CnH2n+1COOH. Для карбоновых кислот характерна изомерия углеродного скелета и межклассовая со сложными эфирами. Существуют ненасыщенные одноосновные карбоновые кислоты с одной, двумя и более двойными связями. Карбоновые кислоты находят широкое применение во многих областях промышленности.
Рассмотрим физические свойства карбоновых кислот. В целом, в ряду гомологов с увеличением молекулярной массы уменьшается растворимость кислот в воде и плотность, а температуры кипения возрастают. Первые три члена гомологического ряда – жидкости, которые имеют резкий запах, начиная с масляной кислоты, идут кислоты, которые являются жидкостями, они обладают неприятным запахом и плохо растворимы в воде.
Для карбоновых кислот характерны более высокие температуры кипения, чем для спиртов и альдегидов с чем же числом атомов углерода. Это объясняется образованием ассоциатов за счёт межмолекулярных водородных связей. Причём у метановой и этановой кислоты прочность водородной связи такова, что даже в газообразном состоянии они существуют в виде димеров.
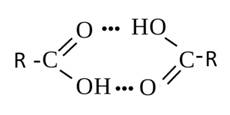
Например, муравьиная кислота представляет собой летучую жидкость с резким неприятным запахом. При попадании на кожу вызывает ожоги. Смешивается с водой в любых соотношениях.
В старину раздражающее действие муравьиной кислоты использовали для лечения ревматизма и подагры. В настоящее время её также применяют для растирания при ревматизме в виде 1 %-го спиртового раствора, который называют муравьиным спиртом. Раньше для его получения муравьёв настаивали на спирту.
 Уксусная кислота известна издавна. Впервые концентрированную уксусную кислоту путём перегонки винного и древесного уксуса в 1537 году получил Парацельс. Парацельс – немецкий естествоиспытатель, врач, философ, один из основателей ятрохимии. Считается одним из основателей современной науки.
Уксусная кислота известна издавна. Впервые концентрированную уксусную кислоту путём перегонки винного и древесного уксуса в 1537 году получил Парацельс. Парацельс – немецкий естествоиспытатель, врач, философ, один из основателей ятрохимии. Считается одним из основателей современной науки.
Уксусная кислота – бесцветная жидкость. При охлаждении ниже 17 0C она превращается в бесцветную кристаллическую массу, похожую на лёд, поэтому её называют «ледяной» уксусной кислотой.
Уксусная эссенция – это 70-80 % водный раствор уксусной кислоты. А 3-9 % раствор уксусной кислоты называется столовым уксусом.
Высшие кислоты, у которых 10 и более атомов углерода, − твёрдые вещества, которые не имеют запаха и нерастворимы в воде.
В 1825 году французские учёные М. Э. Шеврель и Ж. Л. Гей-Люссак получили патент на производство стеариновых свечей. Эти свечи экономичнее восковых, давали яркое пламя и образовывали меньше копоти.
Олеиновая кислота является ненасыщенной одноосновной карбоновой кислотой, представляет собой маслянистую жидкость, которая легче воды, без запаха, нерастворима в воде, но хорошо растворяется в органических растворителях.
Химические свойства карбоновых кислот обусловлены карбоксильной группой. Как и любые кислоты, карбоновые кислоты способны отщеплять атом водорода в виде протона. Так, растворимые в воде кислоты диссоциируют обратимо с образованием иона водорода. При диссоциации уксусной кислоты образуется ацетат-ион и ион водорода. Именно поэтому, раствор уксусной кислоты изменяет окраску индикаторов. Лакмус изменяет окраску с фиолетовой на красную, метиловый оранжевый изменяет окраску с оранжевой на красную.
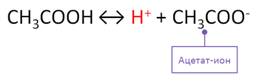
Кислотные свойства карбоновых кислот проявляются в реакциях с активными металлами. Например, в реакции магния с уксусной кислотой образуется соль – ацетат магния, или этаноат магния.
2CH3COOH + Mg → (CH3COO)2Mg + H2↑
Кислотные свойства карбоновых кислот проявляются в реакциях нейтрализации, то есть в реакциях с сильными основаниями. Так, в реакции уксусной кислоты с гидроксидом калия образуется ацетат калия, или этаноат калия. CH3COOH + KOH → CH3COOK + H2O
Карбоновые кислоты реагируют с основными оксидами. Так, в реакции уксусной кислоты с оксидом магния образуется ацетат магния, или этаноат магния. 2CH3COOH + MgO → (CH3COO)2Mg + H2O
Карбоновые кислоты реагируют с солями более слабых кислот. Например, в реакции уксусной кислоты с гидрокарбонатом натрия образуется ацетат натрия, или этаноат натрия, углекислый газ и вода.
CH3COOH + NaHCO3 → CH3COONa + CO2↑ + H2O
Карбоновые кислоты вступают в реакции со спиртами – это реакции этерификации. В реакции уксусной кислоты с метанолом образуется сложный эфир – метиловый эфир уксусной кислоты, или метилэтаноат.
CH3COOH + CH3OH ↔ CH3COOCH3 + H2O
Карбоновые кислоты могут вступать в реакции замещения атома водорода у α-углеродного атома на атом галогена в присутствии красного фосфора. Так, в реакции уксусной кислоты с хлором в присутствии красного фосфора образуется хлоруксусная кислота.
CH3COOH + Cl2 ↔ CH2(Cl)COOH + HCl
Ненасыщенные карбоновые кислоты вступают в реакции присоединения по кратным связям. Акриловая кислота реагирует водородом, при этом образуется пропановая кислота. Акриловая кислота обесцвечивает бромную воду, при этом образуется 2,3-дибромпропановая кислота.

Кроме этого, акриловая кислота может вступать в реакцию полимеризации с образованием полимера.
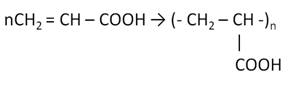
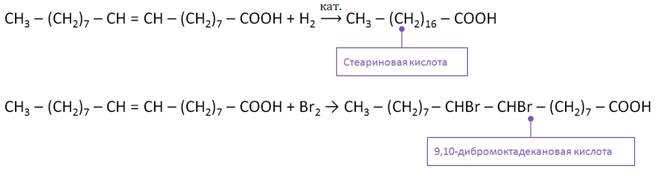
Олеиновая кислота также является непредельной и вступает в реакции присоединения. Например, в реакции олеиновой кислоты с водородом образуется стеариновая кислота. Эта реакция имеет большое значение, так как лежит в основе производства маргарина.
В реакции олеиновой кислоты с бромной водой образуется 9,10-дибромоктадекановая кислота. При этом происходит обесцвечивание бромной воды.
Наиболее распространённым способом получения карбоновых кислот является каталитическое окисление насыщенных углеводородом. Например, при каталитическом окислении бутана образуется уксусная кислота.
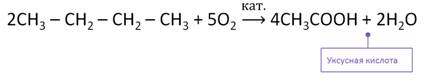
В промышленности кислоты получают окислением соответствующих альдегидов. Так, при окислении уксусного альдегида образуется уксусная кислота.
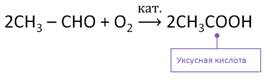
Метановую кислоту в промышленности получают при взаимодействии оксида углерода (II) и горячего раствора гидроксида натрия при повышенном давлении. Сначала образуется соль муравьиной кислоты, которая под действием сильной кислоты превращается в муравьиную.
CO + NaOH → HCOONa
HCOONa + H2SO4 → HCOOH + NaHSO4
Высшие карбоновые кислоты в промышленности получают в результате гидролиза жиров.
В лаборатории карбоновые кислоты можно получить окислением первичных спиртов и альдегидов. Окислителями здесь могут выступать K2Cr2O7, KMnO4.
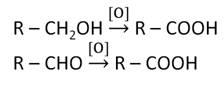
Таким образом, химические свойства карбоновых кислот обусловлены наличием карбоксильной группы. Кислотные свойства карбоновых кислот связаны со способностью атома водорода отщепляться в виде протона. Кислотные свойства карбоновых кислот проявляются в реакциях с металлами, основными оксидами, основаниями и солями слабых кислот. Ненасыщенные кислоты сочетают свойства и карбоновых кислот, и алкенов. Источниками получения карбоновых кислот являются насыщенные углеводороды и их производные.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|