
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Лекция__ОВР в клетке
Лекция__ОВР в клетке
Окислительно-восстановительными (ОВР) называют такие реакции, в процессе которых происходит перенос электронов от донора электронов (восстановителя) к акцептору электронов (окислителю). В некоторых ОВР перенос электронов осуществляется путем передачи атомов водорода, таким образом, дегидрирование и окисление представляют собой по существу два эквивалентных процесса. Возможен параллельный перенос и электрона, и Н-атома. Часто для обозначения электронов и Н-атомов используют «нейтральные» термины: восстановительные и электронные эквиваленты.
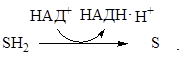
| перенос Н-атомов | (1) |
| (2) |
Окислитель и восстановитель всегда действуют как сопряженные окислительно-восстановительные пары, аналогично тому, как кислоты и основания Бренстеда функционируют как сопряженные кислотно-основные пары:
донор протонов  H+ + акцептор протонов; H+ + акцептор протонов;
| (3) |
 ; ;
| (4) |
донор электронов 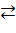 ē + акцептор электронов. ē + акцептор электронов.
| (5) |
Константу равновесия, которая характеризует способность кислоты отдавать протон основанию, можно использовать также для характеристики способности восстановителя отдавать электрон окислителю. Однако эту способность выражают обычно не константой равновесия, а стандартным восстановительным потенциалом, который равен по определению ЭДС (вольты), возникающей в полуэлементе, в котором восстановитель и окислитель, присутствующие в концентрации 1,0 М при 25°С и рН 7,0, находятся в равновесии с электродом, способным обратимо принимать электроны от восстановителя по уравнению:
Восстановитель 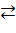 Окислитель + nē , Окислитель + nē ,
| (6) |
где n – число перенесенных электронов.
Стандартный восстановительный потенциал есть мера электронного давления, которое возникает при строго определенных условиях в восстановительно-окислительной паре в состоянии равновесия. В качестве стандарта принят восстановительный потенциал реакции:
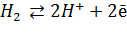 , ,
| (7) |
который при давлении газообразного Н2 = 1 атм при 1,0 М концентрации Н+ (соответствует рН = 0) и при 25°С условно считают равным нулю. Скорректированный для рН = 7,0 ([H+] = 1·10-7 М), стандартный восстановительный потенциал системы Н2 – 2Н+ равен -0,42.
| [H+] = 1,0 M (рН = 0), H2 = 1 атм, 25˚С | E0 = 0 В |
| [H+] = 1·10-7 М (рН = 7,0), H2 = 1 атм, 25˚С | E0' = - 0.42 В (____ напряжений) |
Системы с более отрицательной величиной стандартного окислительного потенциала по сравнению с парой Н2 – 2Н+ обладают большей, чем у водорода, способностью отдавать электроны; с положительным значением – тенденция слабее, чем у водорода. Отметим, что стандартный восстановительный потенциал пары «Н2О – О2»:
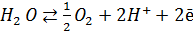
| (4.8) |
равен +0,815. Этим объясняется то, что вода обладает очень слабой способностью отдавать электроны с образованием молекулярного кислорода. В то же время для кислорода характерно высокое сродство к электрону, значительно больше, чем у биологических акцепторов, таких как НАД+, флавопротеиды и цитохромы.
Стандартный восстановительный потенциал ( 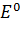 ) связан с
) связан с 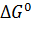 соотношением
соотношением
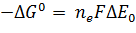 . .
| (9) |
То есть, в дополнение к 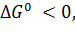 для окислительно-восстановительного процесса вводится еще один критерий самопроизвольного протекания процесса:
для окислительно-восстановительного процесса вводится еще один критерий самопроизвольного протекания процесса: 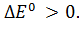
Стандартный восстановительный потенциал данной окислительно-восстановительной пары связан с наблюдаемым потенциалом и концентрацией доноров и акцепторов уравнением Нернста:
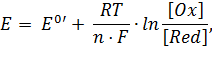
| (10) |
где R = 8,31 Дж/К∙моль, F = 96,406 Дж/В.
Уравнение Нерста представляет собой аналитическое выражение кривой титрования восстановителя каким-либо окислителем: 100% содержанию восстановителя в системе соответствует максимальное отрицательное значение величины 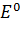 (рис. 1).
(рис. 1).
По мере того, как в процессе титрования добавляется окислитель, все большая доля оттитрованного восстановителя переходит в окисленную форму, то есть, возрастает величина соотношения концентраций акцептора и донора электронов, окислителя и восстановителя соответственно.
Это увеличение происходит до тех пор, пока не будет достигнута некая средняя точка, при которой концентрации акцептора и донора электронов окажутся равными. В этой точке уравнение принимает вид:
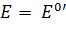 . .
|
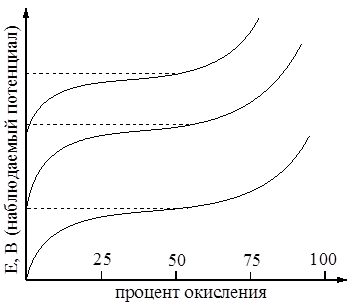
|
| Рисунок 1 |
Знание стандартных восстановительных потенциалов различных окислительно-восстановительных систем позволяет предсказывать направление потока электронов от одной редокс-пары к другой при стандартных условиях (таблица 1).
Таблица 1 – Значения стандартных редокс-потенциалов некоторых сопряженных пар.
| Восстановитель | Окислитель | 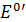 , В , В
|
| Ацетальдегид | ацетат | -0,60 |
| Н2 | 2Н+ | -0,42 |
| изоцитрат | α-кетоглутарат + СО2 | -0,38 |
| НАДН∙Н+ | НАД+ | -0,32 |
| НАДФН∙Н+ | НАДФ+ | -0,32 |
| лактат | пируват | -0,19 |
| Н2О | 1/2О2 | +0,82 |
В следующий раз, на конкретном примере можно будет рассмотреть как можно использовать данный подход для анализа самопроизвольности протекания биохимического процесса с учётом
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|