
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тема: Химическое равновесие. План лекции
Тема: Химическое равновесие
Вид учебного занятия: лекция
Цель учебного занятия: Актуализировать знания о химическом равновесии и условиях при котором оно смещается.
План лекции
1. Кинетическое и термодинамическое описание химического равновесия.
2. Смещение химического равновесия (принцип Ле - Шателье).
3. Равновесия в биологических средах.
1.Обратимыми химическими реакциями называются химические реакции и физико-химические процессы, самопроизвольно протекающие как в прямом, так и в обратном направлении. Уравнение гипотетической обратимой реакции может быть представлено схемой:
аА + bВ  сС +dD
сС +dD
Ниже приведены примеры некоторых обратимых реакций:
N2 + 3 H2  2 NH3
2 NH3
NH4Cl + H2O  NH4OH + HCl
NH4OH + HCl
Hb + O2  HbO2
HbO2
Пределом протекания обратимых процессов является состояние химического равновесия. Химическое равновесие — это такое состояние обратимого процесса, в котором скорость прямой и обратной реакций равны между собой (рисунок 3).
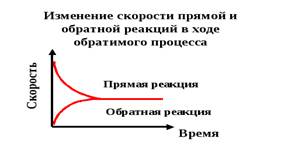
Рисунок 3. Изменение скорости прямой и
обратной реакций в ходе обратимого процесса
Признаком химического равновесия является постоянство во времени концентрации всех веществ, участвующих в процессе (рисунок 4). Концентрации веществ в состоянии химического равновесия называются равновесными: [Ā], моль/л.
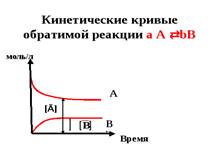
Рисунок 4 — Кинетические кривые
обратимой реакции аА  bВ
bВ
Кинетическое описание химического равновесия основано на законе действующих масс: скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ (Гульдберг-Вааге,1884).
Согласно закону действующих масс, скорости прямой и обратной реакций равны:
υпр = kпр [A]a [B]b
υобр = kобр [C]c [D]d
где υпр — скорость прямой реакции,
υобр — скорость обратной реакции,
kпр — константа скорости прямой реакции,
kобр — константа скорости обратной реакции.
В состоянии равновесия υпр = υобр, следовательно можно записать, что
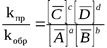
Отношение констант скорости является постоянной величиной, обозначаемой Kc:
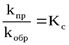
где Kс – концентрационная константа равновесия.
Таким образом, закон действующих масс для обратимой реакции записывается так:
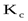
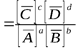
Например, для биохимической реакции окисления гемоглобина в оксигемоглобин
Hb + O2  HbO2
HbO2
константа химического равновесия равна:
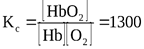
Если в химической реакции участвуют газообразные, жидкие и твердые вещества, то для расчета Кс используют только равновесные концентрации газов.
Например, синтез кристаллической мочевины из углекислого газа и аммиака описывается уравнением:
CO2 (г) + 2 NH3 (г)  H2O (г) + CO(NH2)2 (к).
H2O (г) + CO(NH2)2 (к).
В равновесии участвуют как газообразные, так и твердые вещества, но концентрацию кристаллической мочевины при составлении уравнения для Kc не учитывают:

Если К >> 1, то равновесие смещено вправо, (υпр > υобр); если К << 1, то равновесие смещено влево (υпр< υобр).
В 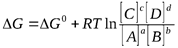 основе термодинамического описания обратимого процесса лежит уравнение изотермы химической реакции:
основе термодинамического описания обратимого процесса лежит уравнение изотермы химической реакции:
где Δ G– это изменение свободной энергии Гиббса в ходе процесса, а Δ Go – стандартное изменение свободной энергии.
В состоянии химического равновесия Δ G = 0, а концентрации веществ А, В, С и D являются равновесными. Соответственно
Δ Go = - RT ln K.
Отсюда
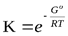
Таким образом, K зависит только от температуры и природы реагирующих веществ.
2. Смещение химического равновесия (принцип Ле- Шателье)
Состояние химического равновесия является наиболее энергетически выгодным состоянием обратимого процесса, так как характеризуется минимальным запасом внутренней энергии системы (G min) (рисунок 5).
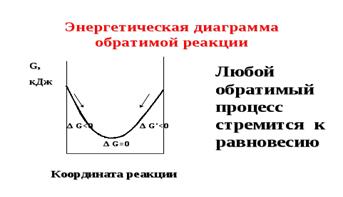
Рисунок 5 — Энергетическая диаграмма
обратимой реакции
Таким образом, любой обратимый процесс стремится к равновесию. В 1884 г. французский физико-химик и металлург Ле -Шателье сформулировал общий закон смещения химического равновесия.
Принцип Ле -Шателье: «Если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие (изменив температуру, давление или концентрации веществ), то положение равновесия сместится таким образом, чтобы ослабить внешнее воздействие».
Этот принцип позволяет предсказать качественные изменения в равновесной системе при изменении условий.
Частные случаи принципа Ле- Шателье:
1) Повышение температуры смещает равновесие в сторону эндотермической, а понижение температуры — в сторону экзотермической реакции.
Рассмотрим влияние температуры на равновесие обратимой биохимической реакции
Hb + O2  HbO2,ΔrН = – 10 кДж.
HbO2,ΔrН = – 10 кДж.
При повышении температуры равновесие смешается влево (кровь отдает кислород тканям), при понижении температуры равновесие смещается вправо (кровь обогащается кислородом).
2) При повышении давления равновесие смещается в сторону меньшего количества газообразных веществ, а при понижении давления — в сторону их большего количества. Изменение давления не влияет на смещение химического равновесия, если: (а) в реакции не участвуют газы; (б) реакция протекает без изменения количества газообразных веществ. Например,
N2 + O2  2NO.
2NO.
Используя данный принцип, можно рассмотреть влияние давления на равновесие обратимой реакции окисления гемоглобина в оксигемоглобин.
Венозная кровь поступает в легкие, где испытывает повышенное давление кислорода О2. В результате равновесие смещается вправо (кровь насыщается кислородом). Артериальная кровь, поступающая в ткани, оказывается при пониженном давлении кислорода, в результате чего равновесие смещается влево (кровь отдает кислород тканям).
3)При увеличении концентрации вещества, участвующего в обратимом превращении, равновесие смещается в сторону той реакции, которая протекает с убылью этого вещества (и наоборот).
Например, при увеличении содержания гемоглобина в крови равновесие смещается вправо (ткани обогащаются кислородом). При недостатке гемоглобина (анемия) равновесие смещается влево (больной страдает от кислородной недостаточности).
3. Равновесие в биологических средах
Важнейшей биологической средой является вода. Описание процессов, протекающих в водных растворах, возможно с позиций теории химического равновесия. Многие процессы, играющие важную роль в метаболизме живых организмов, связаны с обратимым переносом протонов (протолитические равновесия).
К важнейшим протолитическим равновесиям относится диссоциация воды, протекающая по уравнению:
H2O  H+ + OH-
H+ + OH-
Вода – очень слабый электролит; при комнатной температуре из 5 млн. молекул воды только одна молекула диссоциирует на ионы. Поскольку молярная концентрация молекул воды значительно превышает молярную концентрацию ионов ([H2O]>> [H+]) , то можно считать, что концентрация молекул воды является величиной постоянной ([H2O] = const). Применив закон действующих масс, напишем выражение для концентрационной константы равновесия рассматриваемого процесса:
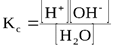
Умножив левую и правую части уравнения на [H2O], получим уравнение
Кс [H2O] = [H+][OH-],
где Kс [H2O] = Kw
Kw — ионное произведение воды; эта величина является константой равновесия, описывающей обратимую диссоциацию воды. При стандартной температуре (t = 25oC) Кw = [H+][OH-] = 10-14.
Для воды и водных растворов:
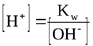
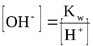
Не менее важным является протолитическое равновесие, устанавливающееся при диссоциации слабых кислот и оснований.
Уксусная кислота является слабым электролитом. Ее диссоциация протекает обратимо по уравнению:
CH3COOH  CH3COO- + H+
CH3COO- + H+
Константа равновесия, описывающая данный обратимый процесс обозначается Ka и называется константой кислотности:
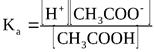
Аммоний гидроксид является слабым электролитом. Его диссоциация протекает обратимо по уравнению:
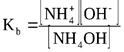
NH4OH  NH4+ + OH-
NH4+ + OH-
Константа равновесия, описывающая данный обратимый процесс обозначается Kb и называется константой основности:
Чем больше Ка и Kb, тем сильнее диссоциируют кислоты и основания в водных растворах.
К протолитическим равновесиям, играющим важную биологическую роль, относятся реакциигидролитического разложения веществ.Гидролиз солей — это реакция ионного обмена между составными частями соли и воды, протекающая с изменением кислотности раствора. Гидролизу подвергаются растворимые соли, в состав которых входят катионы слабых оснований или анионы слабых кислот.
Вопросы для самоконтроля
1. Какие химические реакции называют обратимыми?
2.Что произойдет, если на систему, находящуюся в равновесии оказать внешнее воздействие?
3.В какую сторону сместиться равновесие при повышении температуры и давления?
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|