
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Список литературы
1. В лаборатории имеется фиолетовый кристаллогидрат хлорида кобальта (II) неизвестного состава. При растворении 1. 63 г этого вещества в воде и последующем выпаривании раствора образовались розовые кристаллы кристаллогидрата CoCl2·6H2O массой 2.34 г. Определите состав взятого кристаллогидрата и напишите уравнение произошедшей реакции. Какими реакциями можно показать, что взятое вещество – действительно кристаллогидрат хлорида кобальта?
2. Запишите уравнения превращений, соответствующих следующей схеме:
Cu → CuO → Cu(OH)2 → CuSO4 → CuO → CuS → [Cu(NH3)4]SO4 → CuI → K[CuI2]
Примечание: одной стрелке не обязательно соответствует одна химическая реакция.
3. При электрохимическом нанесении хромовых покрытий на металлические изделия в качестве электролита используют раствор хромовой кислоты. При этом сам обрабатываемый предмет служит одним из электродов; другой электрод является инертным. Каким электродом – анодом или катодом – служит предмет, на который наносят хромовое покрытие? Напишите уравнения электродных полуреакций, происходящих при электрохимическом нанесении покрытия. Рассчитайте количество электричества (в А·ч), необходимое для нанесения 1.0 г хрома.
4. В 1813 году немецкий минеролог Ф. Г. Гаусман исследовал удивительно красивый минерал и предложил ему название – родохрозит (синонимы: малиновый шпат, роза инков). Родохрозит имеет плотность 3,3 – 3,7 г/см3, твердость: 3,5 – 4 , окраску – розовую, оранжево-розовую, малиновую (окраска в порошке – белая). Минерал практически нерастворим в холодной и горячей воде, но быстро растворяется в горячей соляной кислоте (с сильным вскипанием). При растворении 25 г родохрозита в 100 г 20 %-ной соляной кислоты образуется 115,4 г практически бесцветного раствора. При прокаливании навески родохрозита на воздухе образуется темно-серый порошок (потеря массы составляет 33,65 %.). Если прокаливание провести в потоке азота, окраска остатка будет черная со стальным отливом, а потеря массы составляет 38,28 %.
1.Определите состав родохрозита. Установите состав продукта прокаливания родохрозита на воздухе.
2.Напишите уравнения реакций растворения и термического разложения родохрозита.
3.Выберите пять реагентов, при добавлении которых к раствору, полученному растворением родохрозита в соляной кислоте, будут образовываться осадки. Запишите уравнения реакций, происходящих при этом. Если сможете, приведите окраску осадков.
4.Предложите способ лабораторного получения родохрозита. (Уравнения реакций). Обоснуйте выбор реагентов.
5. Металл Хиспользуется человеком с глубокой древности. Многочисленные художественные изделия из этого металла, изготовленные еще в средние века, сохранились и до наших дней, не потеряв своей функциональной привлекательности. В современной технике значение металла Хопределяется не только его широким распространением в природе, но и сочетанием весьма ценных свойств. Он пластичен, легко куется как в холодном, так и нагретом состоянии, поддается прокатке, штамповке и волочению. В чистом виде Хиз-за его низкой прочности практически не используется, зато на долю его сплавов приходится существенно больше половины всей мировой металлической продукции.
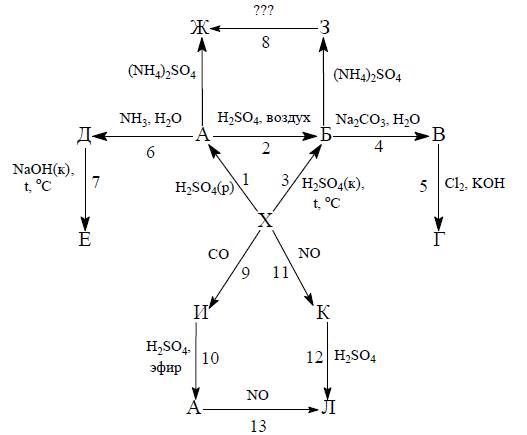
Несмотря на то, что при комнатной температуре Хне растворяется в концентрированных азотной и серной кислотах, химическую активность этого металла обычно характеризуют словом «умеренная» или «средняя». В самом деле, ведь в разбавленной серной кислоте Xрастворяется, образуя раствор вещества A(реакция [1] на схеме). Вещество Ане отличается особой устойчивостью в полученном растворе; при его длительном хранении на воздухе получается раствор вещества Б[2], которое также можно было бы получить, растворяя Хв горячей концентрированной серной кислоте [3].
При обработке раствора Бкарбонатом натрия выпадает бурый осадок вещества B[4]. Пропуская хлор через его взвесь в крепком растворе калиевой щелочи, Bможно превратить в красно-фиолетовое вещество Г[5], которое является таким сильным окислителем, что без труда окисляет аммиак при комнатной температуре. В сильнощелочном растворе Гсохраняется продолжительное время, но вот в кислой или даже нейтральной среде быстро восстанавливается, окисляя воду.
При обработке раствора Аводным раствором аммиака образуется белый осадок соединения Д[6]. Если кипятить этот осадок в 50 %-м растворе NaOH, то Дчастично растворяется [7], а из полученного раствора можно выделить сине-зеленые кристаллы Е. Реакцию [7] обычно проводят в присутствии металлических опилок X.
При добавлении к растворам Aи Бсульфата аммония и охлаждении растворов до 0 °C выпадают устойчивые на воздухе кристаллы солей Жи Зсоответственно.
1.Определите металл Х. Приведите два примера названий художественных изделий, о которых говорится в тексте задачи.
2.Напишите уравнения реакций [1] – [7]. Зачем нужно присутствие Xв реакции [7]?
3.Напишите уравнения реакций Гс аммиаком и водой. Почему вещество Гболее устойчиво в щелочном растворе, чем в кислом или нейтральном?
4.Установите точные составы кристаллов Е, Жи З. Известно, что Есодержит 27,12 % X, а в состав Жвходит 27,55 % кристаллизационной воды. Навеска Змассой 7,233 г выделяет 0,336 л газа (н.у.) в реакции с избытком щелочи, а из образующегося в этой реакции осадка может быть получено 0,838 г Х.
5.Вещества Жи Зизвестны с давних пор и имеют свои собственные, не номенклатурные названия. Приведите эти названия и предложите рациональную методику получения Жиз З(реакция [8]).
Мелко раздробленное вещество Xпри комнатной температуре и высоком давлении реагирует с окисью углерода [9], образуя бледно-желтую жидкость Ис высоким коэффициентом преломления (молекула Исодержит один атом Хи подчиняется правилу 18 электронов). В эфирном растворе Ивступает в реакцию с серной кислотой с образованием соединения А[10].
Вещество К(31,75 % X) впервые было получено Маншо в 1929 году в виде черных кристаллических игл при нагревании до 45 °C соединения Ив автоклавах в атмосфере окиси азота. В настоящее время известно, что Ктакже можно получить обработкой металлической губки Xокисью азота при повышенном давлении [11]. Разбавленной серной кислотой Кразлагается [12] с образованием раствора соединения Л. Раствор того же соединения получается при пропускании окиси азота через раствор вещества А[13]. Эта реакция известна как «проба бурого (коричневого) кольца» и используется в качественном анализе благодаря интенсивному бурому цвету Л, связанному с переносом заряда. Кочень реакционноспособно и реагирует со многими веществами с образованием различных низковалентных и кластерных соединений Х. Например, в реакции Кс гидросульфидом калия образуется черная соль Руссена (39,28 % X,16,91 % S, 17,24 % N, 6,88 % K), обладающая бактерицидными и вазолидативными (снижение кровяного давления) свойствами.
6.Установите составы веществ И, Ки черной соли Руссена.
7.Напишите уравнения реакций [9] – [13].
Список литературы
1. Неорганическая химия (в трех томах). Под ред. академика Ю.Д. Третьякова.
2. Ахметов Н.С. Общая и неорганическая химия.
3. Некрасов Б.В. Основы общей химии
4. Турова Н.Я. Неорганическая химия в таблицах
5. Лидин P. A., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ
Полезные сайты
1. http://www.chem.msu.ru/rus/teaching/inorg.html
2. http://www.chem.msu.ru/rus/olimp/
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|