
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Загадки технологии и секретные фишки правила креста
Загадки технологии и секретные фишки правила креста
До сих пор бурлит публика, обсуждая статьи о вреде пропорции в процессе решения сложных задач по химии и в технологии обучения основам алгоритмики. Ребята, успокойтесь! Не хочу никому ничего навязывать. Вольному воля, спасенному рай! Ученики, решающие задачи системно и так же системно изучающие естественные науки (и химию, и биологию, и физику, и многие другие) будут всегда впереди тех, кто использует исключительно пропорцию, считая ее универсальным инструментом при решении задач по химии!
Любители пропорции, читайте слова старой Песни Старого Извозчика, которую исполнял великий Леонид Утесов. Это про вас:
Эх, подружка верная,
Ну, старушка древняя,
Стань, Маруська, в стороне,
Наши годы длинные,
Мы друзья старинные,
Ты верна, как прежде, мне
Сегодня я дарю конфету! Всем! И любителям, и ненавистникам пропорции. Хочу рассказать о технологии, отработанной для лаборантов (без высшего образования), кто занимается приготовлением растворов для студентов, стажеров, аспирантов и научных сотрудников. Эта технология позволяет среднему уму не строить громоздкие аналитические системные конструкции при решении простеньких задач на приготовление растворов, а быстро сделать расчеты, не заморачиваясь на логике, и приготовить раствор. Встречайте! "Правило креста".
Правило креста - технология пропорциональных расчетов в процессе приготовления растворов.
Ограничения:
1) Используется только в том случае, если известна массовая доля конечного раствора
2) Не используется, если в растворе протекает реакция
3) Не используется для решения задач на растворимость
4) Не развивает логическое мышление обучаемого
Проведем анализ различных вариантов использования правила креста.
Задача 1
Вычислите массу 5%-го раствора хлорида натрия, который нужно добавить к 120 г 30%-го раствора, чтобы получить 15%-й раствор
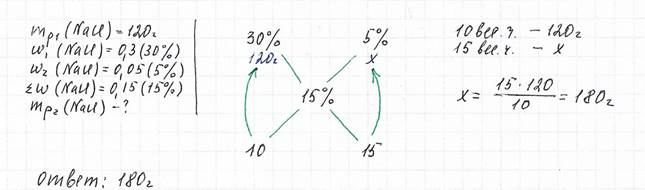
Технологические шаги:
1) Выписываем массовые доли исходных растворов (слева и справа вверху) и массовую долю конечного раствора (посередине ниже)
2) Указываем массу раствора под соответствующей массовой долей
3) Рисуем линии, соединяющие массовые доли исходных растворов и конечного раствора
4) Продолжаем линии ниже и записываем число-разность между большей и меньшей массовыми долями (15-5=10, 30-15=15)
5) Числа внизу - это весовые части соответствующих масс растворов (показаны стрелками). Составляем пропорцию и определяем массу раствора, которую необходимо рассчитать по условию.
Как быть, если к раствору добавляют воду? Все очень просто! Сколько в чистой воде плавает растворенного вещества? Нисколько! Ноль! Значит, пишем ноль (0%) вместо одной и массовых долей. Все остальное - по технологической схеме, описанной выше.
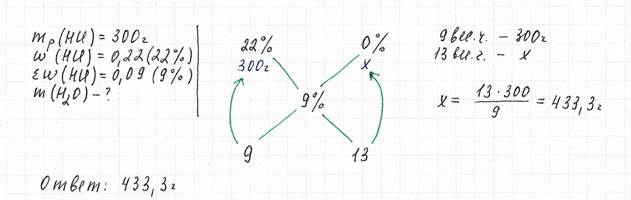
Задача 2
Вычислите массу воды, которую следует добавить к 300 г 22%-го раствора соляной кислоты, чтобы получить 9%-й раствор
А если к раствору добавляют безводную соль? Тоже все просто! Сколько в безводной соли воды? Нисколько! Чистая безводная соль. 100%-ная! Значит, пишем 100% вместо одной из массовых долей. Дальше - по схеме.
Задача 3
Вычислите массу нитрата калия, который нужно растворить в 150 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%
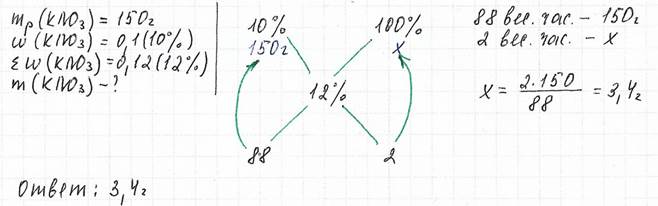
А если к раствору добавляют кристаллогидрат?! (Какой кошмар!!!) Не нужно паниковать. Что такое кристаллогидрат? Это - твердый раствор. Рассчитываем массовую долю безводной соли в кристаллогидрате и записываем ее вместо одной из массовых долей. Дальше - по схеме.
Задача 4
Вычислите массу кристаллогидрата MgSO4•7H2O, который нужно растворить в 69 г воды для получения 15%-го раствора соли

Как поможет нам такая технология? Очень поможет. Дома готовить разные растворы на кухне, на даче (в огороде) нужно? Конечно! В ЦТ по химии более 80% задач можно решить правилом креста. Это не важно, что логическое мышление не развивается. На войне - все средства хороши! Но... заигрываться в пропорцию не советую. Бывают условия аналогичных задач на приготовление растворов, где правило креста может даже навредить.
Думаю, у вас обязательно возникнет вопрос - имеется ли универсальная системная технология для решения любых задач на растворы, которая охватывала бы все разделы - и приготовление растворов, и реакции в растворах, и растворимость? Конечно, имеется! Например методика "Конечная Омега". Но это уже - совсем другая история. Она важна при изучении Царства Растворов, где правят балл массы и массовые доли, а грациозные эн (моли) работают у них исключительно в группах поддержки.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|