
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тема 14. ЗАЧЕТНОЕ ЗАДАНИЕ
Тема 14. ЗАЧЕТНОЕ ЗАДАНИЕ
1. Составьте сокращенные электронные формулы двух элементов: Cr, Oв виде энергетических ячеек. Для второго элемента определите степени окисления в указанных соединениях: H2O2, OF2, NaOH. Составьте структурные формулы. Для каждой химической связи укажите, к какому из атомов смещена электронная плотность химической связи; выделите ионные и ковалентные неполярные связи.
2. Рассчитайте рН и степень диссоциации водных растворов кислоты и основания: H3ВO3 и CsOH(С = 0,1 моль/л). Константа диссоциации слабого электролита Кд1 = 5,8.10-10
3. Напишите выражения констант равновесия для следующих обратимых процессов.
Zn(OH)2(тв) Zn2+(p-p) + 2OH-(p-p)
6CO2(г) + 6H2O (ж) C6H12O6 (тв) + 6O2 (г)
С использованием значений DG 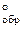 веществ рассчитайте константу равновесия первой реакции и укажите, какие вещества (исходные или продукты) преобладают в системе при равновесии.
веществ рассчитайте константу равновесия первой реакции и укажите, какие вещества (исходные или продукты) преобладают в системе при равновесии.
4. При взаимодействии растворов двух веществ: тетрахлорида тория (ɷ = 0,9 %), V = 15 мл, r = 1 г/мл) и карбоната натрия (С = 0,04 моль/л) протекает стехиометрическая реакция с образованием средней соли. Определите объем раствора карбоната натрия.
5. Какая из приведенных ниже двух реакций протекает с большей скоростью и почему? Приблизительно оцените величину энергии активации обеих реакций
а) Ba + 2H2O ® Ba(OH)2 + H2; б) Ва2+ + 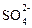 ® ВаSO4
® ВаSO4
6. Для гомогенной реакции по известным равновесным концентрациям компонентов рассчитайте:
а) неизвестную равновесную концентрацию продукта;
б) константу равновесия реакции;
в) начальные концентрации исходных веществ, если начальные концентрации продуктов были равны нулю.
| Уравнение реакции | 2HCl + F2 D 2HF + Cl2 |
| Равновесные конц. компонентов, моль/л | 0,2 0,1 0,1 |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|