
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Задача №1.. Вариант №9.. Ответ: работа когезии жидкости превышает работу адгезии фаз в 526,3 раза.. Задача №2.. Вариант №9.
Министерство образования и науки Российской Федерации
ФГАОУ ВО «УрФУ имени первого Президента России Б.Н. Ельцина»
Институт новых материалов и технологий
Домашняя работа
по дисциплине:
«Физико-химические и теплофизические основы металлургических технологий»
Студент: Кокшин А.А.
Группа: НМТЗМ-102203
Проверил: Климов А.В.
Екатеринбург 2021
Задача №1.
Вариант №9.
Дано:
Поверхностное натяжение расплава равно sж = 500 мДж/м2 . Угол смачивания твердой поверхности этой жидкостью составляет 175°. Определить, во сколько раз работа когезии жидкости превышает работу адгезии фаз.
Решение:
Для нахождения работы адгезии воспользуемся уравнением Дюпре-Юнга:
Wа= sж*(1+cosα)
Работа когезии при этом равна:
Wк= 2*sж
Следовательно, соотношение между работой когезии жидкости и работой адгезии фаз составит:
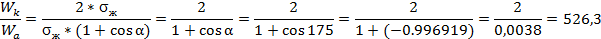
Ответ: работа когезии жидкости превышает работу адгезии фаз в 526,3 раза.
Задача №2.
Вариант №9.
Дано:
Используя приведенную диаграмму, определить значение активности и коэффициента активности FeO в шлаке указанного состава при температуре 1600 °С. Рассчитать активность FeO по теориям совершенных и регулярных ионных растворов, полимерной модели. Сравнить результаты. Оценить расчетные погрешности.
| Вариант | Состав шлака, масс. % | |||||
| CaO | MnO | MgO | FeO | Si 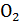
| 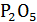
| |
| 44,0 | 15,2 | 7,3 | 12,7 | 14,6 | 6,2 | |
Решение:
Расчет молекулярных масс веществ:
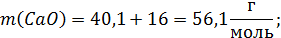
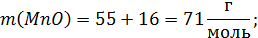
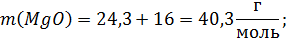
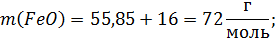
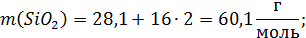
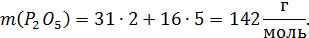
Поскольку масса шлака в условии не указана, то для расчета используем массу шлака, равную 100г.
Количество молей компонентов в 100г шлака:
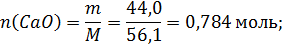
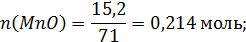
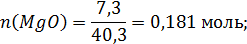
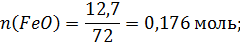
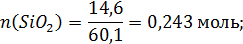
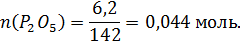
Общее число молей в 100 граммах шлака:
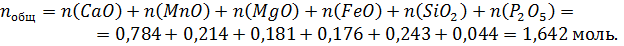
Состав шлака в мольных процентах находим делением числа молей каждого компонента в 100 г шлака на общее число молей, умножая полученное значение на 100%.
Состав шлака в мольных процентах:
|
| CaO | MnO | MgO | FeO | SiO2 | P2O5 | ||
| x, мол. % | 47,75 | 13,03 | 11,02 | 10,72 | 14,80 | 2,68 |
%(CaO+MnO+MgO) 47,75+13,03+11,02=71,8%;
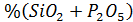 =14,8+2,68=17,48%.
=14,8+2,68=17,48%.
Отложим на оси молярные проценты, проведем параллельные прямые к сторонам треугольника и найдем точку их пересечения, которая будет соответствовать составу заданного шлака.
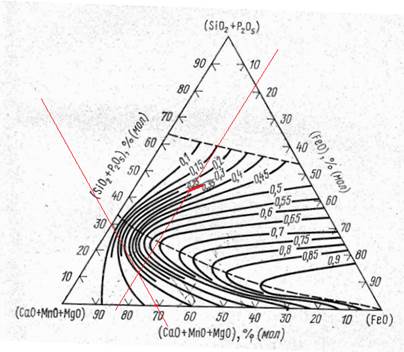
Экспериментально определенная активность FeO в этом шлаке = 0,3.
Коэффициент активности FeO:
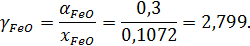
1. Расчет активности и коэффициента активности FeO по теории совершенных ионных растворов:
В соответствии с теорией совершенного ионного раствора жидкий шлак состоит из ионов: 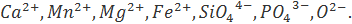 Число молей компонентов в 100 граммах шлака были рассчитаны ранее.
Число молей компонентов в 100 граммах шлака были рассчитаны ранее.
Общее число гамм-ионов катионов и анионов в шлаке:
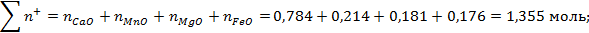
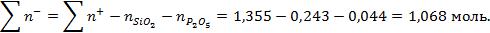
Число гамма-ионов анионов кислорода:
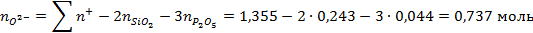
Ионные доли катиона железа и аниона кислорода:
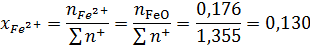
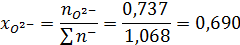
Активность FeO:
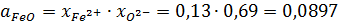
Коэффициент активности FeO:
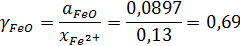
Расчетная погрешность определения активности FeO:
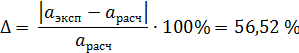
2. Рассчитаем активности и коэффициента активности FeO по теории регулярных ионных растворов
Сумма грамм-ионов всех катионов в 100 г шлака:
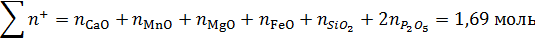
Ионные доли катионов в шлаковом расплаве:
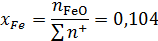
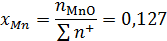
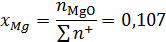
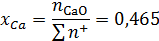
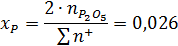
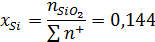
Коэффициент активности катиона железа:
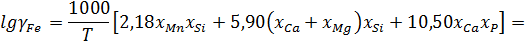
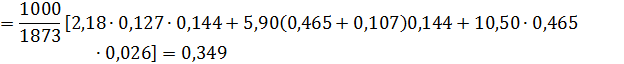
Для вычисления коэффициента активности катиона железа воспользуемся функцией, обратной десятичному логрифму.
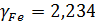
Активность FeO:
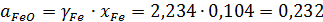
Расчетная погрешность определения активности FeO:
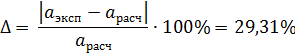
3. Расчет активности и коэффициента активности FeO по полимерной модели:
| CaO | MnO | MgO | FeO | SiO2 | P2O5 | |
| Мас. % | 15,2 | 7,3 | 12,7 | 14,6 | 6,2 | |
| M | 56,1 | 40,3 | 60,1 | |||
| n | 0,784 | 0,214 | 0,181 | 0,176 | 0,243 | 0,044 |
| nобщ | 1,642 | |||||
| N | 0,4775 | 0,1303 | 0,1102 | 0,1072 | 0,1480 | 0,0268 |
Таблица 3. Константы полимеризации в бинарных оксидных расплавах при 1873 К [1]
| Оксид | Кп, MeO-SiO2 | Кп, MeO-P2O5 |
| CaO | 0,16‧10-2 | 0,20‧10-2 |
| MgO | 0,025 | 0,025 |
| MnO | 0,19 | 0,19 |
| FeO | 1,0 | 0,80 |
Константу полимеризации в многокомпонентных системах находим методом логарифмического усреднения констант полимеризации для разных бинарных систем:
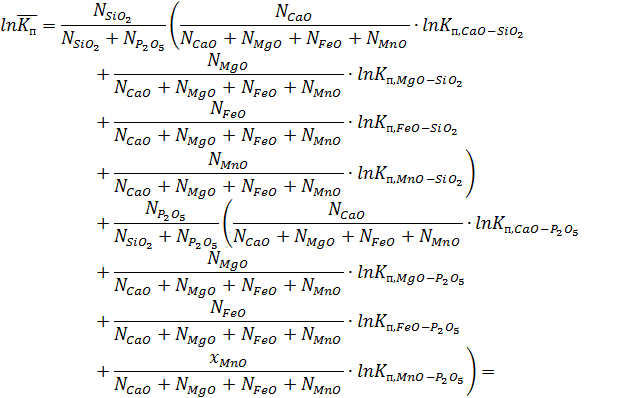
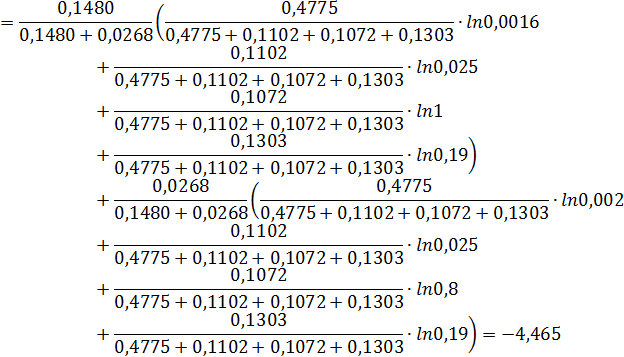
Для вычисления константы полимеризации воспользуемся функцией, обратной натуральному логарифму.
Тогда 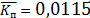
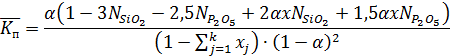
Для определения степени полимеризации α необходимо привести данное уравнение к квадратному уравнению виду:
Аα2 + Вα + С = 0, где
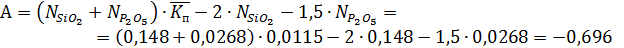
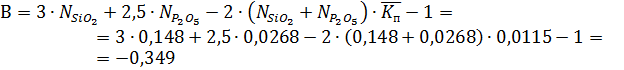
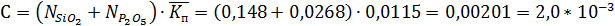
Подставляя значения А, В, С в уравнение
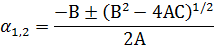
находим, что α1 = -0,00188, а α2 = 0,36033. Из двух корней действительнымявляется α2 = α = 0,36033.
Находим ионную долю «свободных» ионов кислорода:
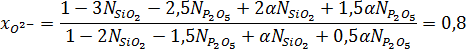
Находим катионную долю железа в шлаке:
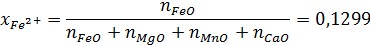
Активность оксида железа:

Для вычисления активности железа используем функцию, обратную натуральному логарифму.
Тогда αFeO = 0,4272
Коэффициент активности FeO:
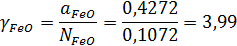
Расчетная погрешность определения активности FeO:
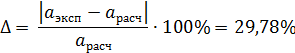
По полученным значениям можно сделать вывод, что наименьшая погрешность определения активности оксида железа наблюдается при расчете по теории регулярных ионных растворов. При этом погрешность определения активности FeO составила 29,31%.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|