
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Лабораторная работа №1. Приготовление раствора заданной концентрации. Приготовление раствора с заданной массовой долей из навески соли.
Лабораторная работа №1
Приготовление раствора заданной концентрации
ВАРИАНТ 12
Сливкин
Приготовление раствора с заданной массовой долей из навески соли.
| № варианта | Название соли | Массовая доля соли, % | Плотность раствора теорет., г/см3 |
| Нитрат калия (KNO3) | 1,0762 |
1) Расчет массы соли.
V(р-ра) = 50 мл.
Найдем массу раствора по формуле

Найдем массу растворенного хлорида натрия
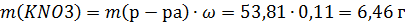
Найдем массу воды
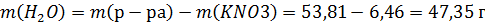
8,928 г NaCl перенесли в мерную колбу. Небольшими порциями влили воду в колбу при постоянном перемешивании. После растворения соли довели раствор до метки. Полученный раствор перелили в цилиндр (на 50 мл) и ареометром измерили его плотность.
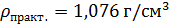
2) Рассчитаем погрешность эксперимента:
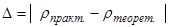 (абсолютная погрешность)
(абсолютная погрешность)

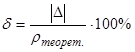 (относительная погрешность).
(относительная погрешность).
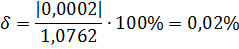
3) Пересчет процентной концентрации в другие концентрации
Вычислим молярную концентрацию раствора

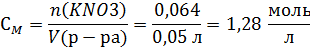
Найдем нормальную концентрацию раствора
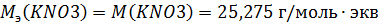
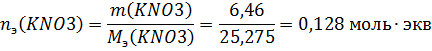
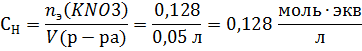
Найдем моляльную концентрацию раствора

Найдем титр раствора
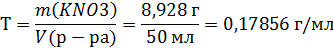
Найдем мольную долю хлорида натрия
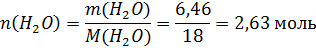
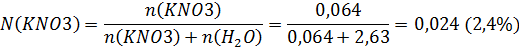
Полученные результаты представим в виде таблицы
Экспериментальные результаты
| Раствор | Концентрации | |||||||
| Масса соли, г | Масса р-ра,г |  , г/мл , г/мл
|  ,
% ,
%
| СМ, моль/л | СН, моль/л | Т, г/мл | Сm, моль/кг | Nсоли |
| 6,46 | 53,81 | 1,076 | 1,28 | 2,55 | 0,129 | 1,35 | 0,024 | |
Вывод: 1) Метод денсиметрии заключается в измерении плотности раствора ареометром.
Ареометр представляет собой поплавок с дробью или ртутью и узким отростком – трубкой, в которой находится шкала с делениями. Он погружается в различных жидкостях на различную глубину. При этом он вытесняет объемы этих жидкостей одной и той же массы, равной массе ареометра, следовательно, обратно пропорциональные их плотности. То деление шкалы, до которого ареометр погружается в жидкость, показывает плотность этой жидкости.
2) Концентрация – это важнейшая характеристика любого раствора. Она определяет содержание вещества в единице массы или объема раствора (иногда растворителя).
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|