
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
пятница. Контрольная работа. Соединения химических элементов. ВАРИАНТ-2
22.01.2021 пятница
8 класс
| Урок | Предмет | Ссылка на задание | ||||
| Химия Папулов Н.И. | На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания - 1 балл.
Часть 2 состоит из 3 заданий повышенного уровня (В1-В3), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания - 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Максимальноты можешь набрать 15 баллов. Желаю успеха!
Система оценивания работы.
|
Контрольная работа
Соединения химических элементов
ВАРИАНТ-2
Часть 1
| При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа. |
А1. Чистое вещество в отличие от смеси - это:
| 1) морская вода | 3) кислород |
| 2) воздух | 4) молоко |
А2.Ряд формул, в котором все вещества – основания:
| 1) СuOH, CuCl2, NaOH | 3) Ca(OH)2, Mg(OH)2, MgOHCl |
| 2) K2O, HCl, Ca(OH)2 | 4) KOH, Ba(OH)2, Cu(OH)2 |
A3.Углерод проявляет наименьшую степень окисления в соединении с формулой:
| 1) СаСО3 | 3) СO2 |
| 2) СH4 | 4) СO |
А4.Формула хлорида меди (II):
| 1) CuCl | 3) CuCl2 |
| 2) Cu(NO3)2 | 4) CuSO4 |
А5.В 180г воды растворили 20г хлорида натрия. Массовая доля соли в полученном растворе равна:
| 1) 15% | 3) 30% |
| 2) 20% | 4) 10% |
А6.Верны ли следующие высказывания?
А. В состав кислот входит ион водорода.
Б. В состав кислот входит кислотный остаток.
| 1) верно только А | 3) верно только Б |
| 2) верны оба суждения | 4) оба суждения не верны |
Часть 2
| В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться). |
В1.Установите соответствие между названием вещества и формулой соединения:
| Название вещества: | Формула соединения: |
| А) Оксид магния | 1) MnCl2 |
| Б) Соляная кислота | 2) Mg(OH)2 |
| В) Гидроксид магния | 3) HF |
| Г) Хлорид магния | 4) HCl |
| 5) MgCl2 | |
| 6) MgO |
| А | Б | В | Г |
| Ответом к заданию В2 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов. |
В2. К солям относятся:
| 1) H2CO3 | 3) Ba(OH)2 | 5)Na2S |
| 2) KNO3 | 4) SO2 | 6) CaCO3 |
| Ответом к заданию В3 является число. Запишите это число в бланк ответов без указания единиц измерения. |
B3. Массовая доля (%) кислорода в оксиде алюминия равна ______.(Запишите число с точностью до десятых).
Часть 3
| Запишите номер задания и полное решение. |
C1.Рассчитайте объём воздуха, необходимого для получения 39л азота, если известно, что объёмная доля азота в воздухе составляет 78%?
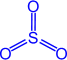 Физические свойства
Бесцветная летучая маслянистая жидкость, t°пл. = 17°C; t°кип. = 66°С;
SO3 хорошо растворяется в 100%-ной серной кислоте, этот раствор называется олеумом.
Химические свойства
Серный ангидрид - кислотный оксид, образует два ряда солей - средние (сульфаты) и кислые (гидросульфаты). SO3 - сильный окислитель.
Взаимодействие с основаниями
2NaOH + SO3 → Na2SO4 + H2O
NaOH + SO3 (избыток) → NaHSO4
Взаимодействие с основными оксидами
Na2O + SO3 → Na2SO4
Взаимодействие с водой
SO3 на воздухе "дымит", сильно поглощает влагу, т.к. энергично соединяется с водой, образуя туман из капелек серной кислоты (хранят в запаянных сосудах). Растворяясь в воде, выделяет большое количество тепла и, если прибавлять не постепенно, а сразу большое количество оксида, то может произойти взрыв. Если капля H2O попадает на оксид серы(VI), то происходит реакция со взрывом.
SO3 + H2O → H2SO4
-С оксидом разобрались. Теперь перейдем к кислоте. Следует вспомнить технику безопасности при работе с этой кислотой. Давайте запишем в тетрадь.
Запомни:
Сначала -вода,
Затем –кислота
Иначе случится беда!
Работать с серной кислотой следует очень осторожно. Серная кислота вызывает сильные ожоги кожи. Поэтому при работе с ней нужно строго соблюдать правила техники безопасности.
- Используя знания, полученные ранее заполним таблицу
- теперь рассмотрим строение молекулы серной кислоты и её свойства.
СЕРНАЯ КИСЛОТА - H2SO4
Физические свойства
Бесцветная летучая маслянистая жидкость, t°пл. = 17°C; t°кип. = 66°С;
SO3 хорошо растворяется в 100%-ной серной кислоте, этот раствор называется олеумом.
Химические свойства
Серный ангидрид - кислотный оксид, образует два ряда солей - средние (сульфаты) и кислые (гидросульфаты). SO3 - сильный окислитель.
Взаимодействие с основаниями
2NaOH + SO3 → Na2SO4 + H2O
NaOH + SO3 (избыток) → NaHSO4
Взаимодействие с основными оксидами
Na2O + SO3 → Na2SO4
Взаимодействие с водой
SO3 на воздухе "дымит", сильно поглощает влагу, т.к. энергично соединяется с водой, образуя туман из капелек серной кислоты (хранят в запаянных сосудах). Растворяясь в воде, выделяет большое количество тепла и, если прибавлять не постепенно, а сразу большое количество оксида, то может произойти взрыв. Если капля H2O попадает на оксид серы(VI), то происходит реакция со взрывом.
SO3 + H2O → H2SO4
-С оксидом разобрались. Теперь перейдем к кислоте. Следует вспомнить технику безопасности при работе с этой кислотой. Давайте запишем в тетрадь.
Запомни:
Сначала -вода,
Затем –кислота
Иначе случится беда!
Работать с серной кислотой следует очень осторожно. Серная кислота вызывает сильные ожоги кожи. Поэтому при работе с ней нужно строго соблюдать правила техники безопасности.
- Используя знания, полученные ранее заполним таблицу
- теперь рассмотрим строение молекулы серной кислоты и её свойства.
СЕРНАЯ КИСЛОТА - H2SO4
 Физические свойства
Тяжелая маслянистая жидкость ("купоросное масло"); r= 1,84 г/см3; нелетучая, хорошо растворима в воде – с сильным нагревом; t°пл. = 10,3°C, t°кип. = 296°С,
Химические свойства серной кислоты
H2SO4 - сильная двухосновная кислота, водный раствор изменяет окраску индикаторов (лакмус и универсальный индикатор краснеют)
Диссоциация протекает ступенчато:
H2SO4→ H+ + HSO4- (первая ступень, образуется гидросульфат – ион)
HSO4- → H+ + SO42- (вторая ступень, образуется сульфат – ион)
H2SO4 образует два ряда солей - средние (сульфаты) и кислые (гидросульфаты)
Взаимодействие с металлами:
Разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода:
Zn0 + H2+1SO4(разб) → Zn+2SO4 + H20↑
Zn0 + 2H+ → Zn2+ + H20↑
Взаимодействие с основными и амфотерными оксидами:
CuO + H2SO4 → CuSO4 + H2O
CuO + 2H+ → Cu2+ + H2O
Взаимодействие с основаниями:
H2SO4 + 2NaOH → Na2SO4 + 2H2O (реакция нейтрализации)
H+ + OH- → H2O
Если кислота в избытке, то образуется кислая соль:
H2SO4 + NaOH → NaНSO4 + H2O
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
2H+ + Cu(OH)2 → Cu2+ + 2H2O
образование газа -как сильная нелетучая кислота серная вытесняет из солей другие менее сильные кислоты, например, угольную
MgCO3 + H2SO4 → MgSO4 + H2O + CO2↑
MgCO3 + 2H+ → Mg2+ + H2O + CO2↑
Качественная реакция на сульфат-ион:
Образование белого осадка BaSO4 (нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов. Ион бария реактив на сульфат –ион.
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Ba2+ + SO42- → BaSO4↓
Применение серной кислоты
Благодаря своим свойствам (способность поглощать воду, окислительные свойства, нелетучесть) серную кислоту широко применяют в народном хозяйстве. Она относится к основным продуктам химической промышленности. Нет кислоты,которая была бы нужнее и применялась бы чаще, чем серная. За это она получила название , «хлеб химической промышленности»
Физические свойства
Тяжелая маслянистая жидкость ("купоросное масло"); r= 1,84 г/см3; нелетучая, хорошо растворима в воде – с сильным нагревом; t°пл. = 10,3°C, t°кип. = 296°С,
Химические свойства серной кислоты
H2SO4 - сильная двухосновная кислота, водный раствор изменяет окраску индикаторов (лакмус и универсальный индикатор краснеют)
Диссоциация протекает ступенчато:
H2SO4→ H+ + HSO4- (первая ступень, образуется гидросульфат – ион)
HSO4- → H+ + SO42- (вторая ступень, образуется сульфат – ион)
H2SO4 образует два ряда солей - средние (сульфаты) и кислые (гидросульфаты)
Взаимодействие с металлами:
Разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода:
Zn0 + H2+1SO4(разб) → Zn+2SO4 + H20↑
Zn0 + 2H+ → Zn2+ + H20↑
Взаимодействие с основными и амфотерными оксидами:
CuO + H2SO4 → CuSO4 + H2O
CuO + 2H+ → Cu2+ + H2O
Взаимодействие с основаниями:
H2SO4 + 2NaOH → Na2SO4 + 2H2O (реакция нейтрализации)
H+ + OH- → H2O
Если кислота в избытке, то образуется кислая соль:
H2SO4 + NaOH → NaНSO4 + H2O
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
2H+ + Cu(OH)2 → Cu2+ + 2H2O
образование газа -как сильная нелетучая кислота серная вытесняет из солей другие менее сильные кислоты, например, угольную
MgCO3 + H2SO4 → MgSO4 + H2O + CO2↑
MgCO3 + 2H+ → Mg2+ + H2O + CO2↑
Качественная реакция на сульфат-ион:
Образование белого осадка BaSO4 (нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов. Ион бария реактив на сульфат –ион.
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Ba2+ + SO42- → BaSO4↓
Применение серной кислоты
Благодаря своим свойствам (способность поглощать воду, окислительные свойства, нелетучесть) серную кислоту широко применяют в народном хозяйстве. Она относится к основным продуктам химической промышленности. Нет кислоты,которая была бы нужнее и применялась бы чаще, чем серная. За это она получила название , «хлеб химической промышленности»
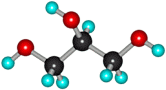
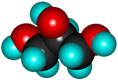 Физические свойства глицерина
Физические свойства глицерина
 Глицерин –бесцветная, вязкая жидкость, сладкая на вкус, без запаха, обладает высокой гидроскопичностью. Глицерин хорошо растворяется в воде, в чем вы убедитесь простотрев опыт «Изучение физических свойств глицерина».
Химические свойства
Химические свойства глицерина так же, как и этанола, обусловлены наличием гидроксильных групп в составе молекул, поэтому во многом сходны со свойствами одноатомных спиртов.
1. Глицерин взаимодействует со щелочными металлами. В этой реакции атомы водорода в гидроксильных группах так же, как и у этанола, замещаются на атомы металлов.
Уравнение реакции глицерина с натрием можно представить так:
CH2-OH CH2-O Na
│ │
2 CH –OH + 6 Na → 2 CH –O Na + 3H2↑
│ │
CH2-OH CH2-O Na
глицерин тринатрийглицерат
Глицерин –бесцветная, вязкая жидкость, сладкая на вкус, без запаха, обладает высокой гидроскопичностью. Глицерин хорошо растворяется в воде, в чем вы убедитесь простотрев опыт «Изучение физических свойств глицерина».
Химические свойства
Химические свойства глицерина так же, как и этанола, обусловлены наличием гидроксильных групп в составе молекул, поэтому во многом сходны со свойствами одноатомных спиртов.
1. Глицерин взаимодействует со щелочными металлами. В этой реакции атомы водорода в гидроксильных группах так же, как и у этанола, замещаются на атомы металлов.
Уравнение реакции глицерина с натрием можно представить так:
CH2-OH CH2-O Na
│ │
2 CH –OH + 6 Na → 2 CH –O Na + 3H2↑
│ │
CH2-OH CH2-O Na
глицерин тринатрийглицерат
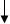 + Nа2 SO4 Cu2+ + 2OH– = Cu(OH)2 ↓
+ Nа2 SO4 Cu2+ + 2OH– = Cu(OH)2 ↓
 Важной реакцией является реакция с азотной кислотой.
СH2-OH CH2-O- NO2
| + 3HO-NO2 | + 3H2O
CH -OH CH- O- NO2
| |
CH2-OH CH2 –O-NO2
тринитроглицирин
Применение многоатомных спиртов (самостоятельная работа с учебником)
Где используются и какими свойствами обладают многоатомные спирты на примере глицерина и этиленгликоля?
Многоатомные спирты находят широкое и разнообразное применение. Глицерин –широко используется в косметике, фармацевтической и пищевой промышленности, а также при выделке кожи.В косметических средствахглицерин играет роль смягчающего средства.Глицерин добавляют к зубной пасте, чтобы предотвратить ее высыхание.К кондитерским изделиямглицерин добавляют для предотвращения их кристаллизации.
В промышленностиглицерин используют для производства взрывчатых веществ. Спиртовой раствор нитроглицеринаиспользуется как средство для расширения кровеносных сосудов при некоторых заболеваниях сердечно-сосудистой системы.
Двухатомный спирт этиленгликольприменяется в качестве антифриза – незамерзающей жидкости для охлаждения двигателей внутреннего сгорания. Этиленгликоль широко используется как исходное вещество для получения синтетическоговолокна лавсан,которое производят на ОАО «Могилевхимволокно».
IV.Закрепление материала
Тест «Многоатомные спирты»
1. Многоатомные спирты – это:
а) спирты, имеющие длинные углеводородные радикалы;
б) спирты с разветвленным строением углеводородного радикала;
в) спирты, имеющие несколько спиртовых функциональных групп.
2. К многоатомным спиртам не относится:
а) этиленгликоль; б) фенол; в) глицерин.
3. Глицерин не взаимодействует с:
а) натрием; б) угарным газом; в) азотной кислотой.
4. Взаимодействие с каким из приведенных ниже веществ является качественной реакцией на глицерин:
а) бром; б) гидроксид меди(II); в) хлорид железа(III).
5. Многоатомные спирты находят широкое и разнообразное применение в:
а) производстве синтетического каучука; б) получении ацетилена, необходимого для сварочных работ; в) косметике, фармацевтической и пищевой промышленности.
Д.з.
Проверочная работа Спирты (отправить в личку до 29.01).
Часть А. Тестовые задания с выбором ответа
1. Общая формула одноатомных спиртов:
А. R-СНО. Б. R-ОН. В. R-О-R1. Г. R-СООН.
2. Трехатомным спиртом является:
А. Этанол. В. Глицерин.
Б. Этиленгликоль. Г. Метанол.
3. Название вещества, формула которого СН3 – СН – СН2 – СН3:
ОН
А. Бутанол-1. Б. Пропанол-2. В. Бутаналь. Г. Бутанол-2.
4. Вид изомерии, характерный для предельных одноатомных спиртов:
А. Изомерия положения кратной связи. В. Изомерия положения функциональной группы.
Б. Пространственная изомерия. Г. Все ответы верны.
5. Вещество, которое не вступает в реакцию с этиловым спиртом:
А. Калий. В. Оксид меди (II).
Б. Кислород. Г. Гидроксид натрия.
6. Среди предельных одноатомных спиртов самым ядовитым является:
А. Этиловый. Б. Метиловый. В. Пропиловый. Г. Бутиловый.
7. Многоатомным спиртом является:
А. Этиленгликоль. Б. Метанол. В. Этанол. Г. Пропанол-2.
Часть Б. Задания со свободным ответом
8. Составьте уравнения реакций по схеме:
этан ----->1 этен-----> 2 этанол-----> 3 этилат натрия.
Укажите условия их осуществления.
9.Дайте определение понятия «реакция дегидратации».
10.Задача. Сколько этилена (в л) может быть получено из 4,6 г этилового спирта, если выход этилена составляет 90% от теоретически возможного.
Важной реакцией является реакция с азотной кислотой.
СH2-OH CH2-O- NO2
| + 3HO-NO2 | + 3H2O
CH -OH CH- O- NO2
| |
CH2-OH CH2 –O-NO2
тринитроглицирин
Применение многоатомных спиртов (самостоятельная работа с учебником)
Где используются и какими свойствами обладают многоатомные спирты на примере глицерина и этиленгликоля?
Многоатомные спирты находят широкое и разнообразное применение. Глицерин –широко используется в косметике, фармацевтической и пищевой промышленности, а также при выделке кожи.В косметических средствахглицерин играет роль смягчающего средства.Глицерин добавляют к зубной пасте, чтобы предотвратить ее высыхание.К кондитерским изделиямглицерин добавляют для предотвращения их кристаллизации.
В промышленностиглицерин используют для производства взрывчатых веществ. Спиртовой раствор нитроглицеринаиспользуется как средство для расширения кровеносных сосудов при некоторых заболеваниях сердечно-сосудистой системы.
Двухатомный спирт этиленгликольприменяется в качестве антифриза – незамерзающей жидкости для охлаждения двигателей внутреннего сгорания. Этиленгликоль широко используется как исходное вещество для получения синтетическоговолокна лавсан,которое производят на ОАО «Могилевхимволокно».
IV.Закрепление материала
Тест «Многоатомные спирты»
1. Многоатомные спирты – это:
а) спирты, имеющие длинные углеводородные радикалы;
б) спирты с разветвленным строением углеводородного радикала;
в) спирты, имеющие несколько спиртовых функциональных групп.
2. К многоатомным спиртам не относится:
а) этиленгликоль; б) фенол; в) глицерин.
3. Глицерин не взаимодействует с:
а) натрием; б) угарным газом; в) азотной кислотой.
4. Взаимодействие с каким из приведенных ниже веществ является качественной реакцией на глицерин:
а) бром; б) гидроксид меди(II); в) хлорид железа(III).
5. Многоатомные спирты находят широкое и разнообразное применение в:
а) производстве синтетического каучука; б) получении ацетилена, необходимого для сварочных работ; в) косметике, фармацевтической и пищевой промышленности.
Д.з.
Проверочная работа Спирты (отправить в личку до 29.01).
Часть А. Тестовые задания с выбором ответа
1. Общая формула одноатомных спиртов:
А. R-СНО. Б. R-ОН. В. R-О-R1. Г. R-СООН.
2. Трехатомным спиртом является:
А. Этанол. В. Глицерин.
Б. Этиленгликоль. Г. Метанол.
3. Название вещества, формула которого СН3 – СН – СН2 – СН3:
ОН
А. Бутанол-1. Б. Пропанол-2. В. Бутаналь. Г. Бутанол-2.
4. Вид изомерии, характерный для предельных одноатомных спиртов:
А. Изомерия положения кратной связи. В. Изомерия положения функциональной группы.
Б. Пространственная изомерия. Г. Все ответы верны.
5. Вещество, которое не вступает в реакцию с этиловым спиртом:
А. Калий. В. Оксид меди (II).
Б. Кислород. Г. Гидроксид натрия.
6. Среди предельных одноатомных спиртов самым ядовитым является:
А. Этиловый. Б. Метиловый. В. Пропиловый. Г. Бутиловый.
7. Многоатомным спиртом является:
А. Этиленгликоль. Б. Метанол. В. Этанол. Г. Пропанол-2.
Часть Б. Задания со свободным ответом
8. Составьте уравнения реакций по схеме:
этан ----->1 этен-----> 2 этанол-----> 3 этилат натрия.
Укажите условия их осуществления.
9.Дайте определение понятия «реакция дегидратации».
10.Задача. Сколько этилена (в л) может быть получено из 4,6 г этилового спирта, если выход этилена составляет 90% от теоретически возможного.