
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ЗДРАВСТВУЙТЕ РЕБЯТА!
ЗДРАВСТВУЙТЕ РЕБЯТА!
Щелочные металлы. Физические и химические свойства. Оксиды и гидроксиды щелочных металлов
В Периодической системе химических элементов щелочные металлы находятся в первой группе главной подгруппе. Свое название получили благодаря растворимым основаниям – щелочам, которые они образуют. На внешнем энергетическом уровне в атомах щелочных металлов находится один электрон, который атомы легко отдают.
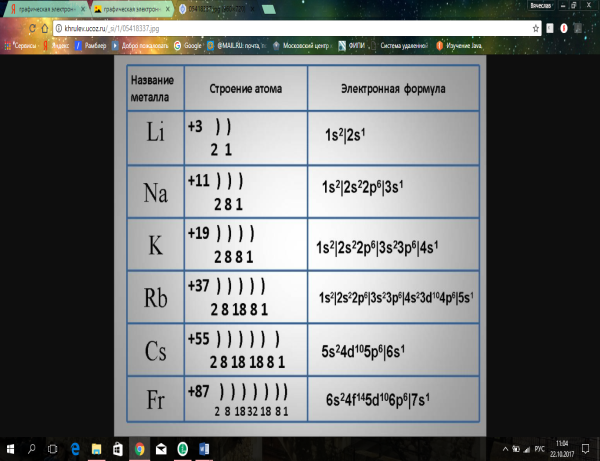
Щелочные металлы – сильные восстановители, их активность усиливается от лития к францию. Во всех соединениях щелочные металлы проявляют степень окисления +1.
Все щелочные металлы серебристо-белого цвета (цезий – серебристо-желтого цвета), мягкие, легкоплавкие. Твердость и температура плавления понижается от лития к францию (радиоактивный металл): Li Na K Rb Cs Fr
Из-за своей химической активности в лаборатории щелочные металлы хранятся под слоем керосина или машинного масла, а также в запаянных ампулах в вакууме.
Щелочные металлы взаимодействуют с простыми веществами. Вступая в реакцию с кислородом, только литий образует оксид, остальные щелочные металлы – пероксиды и надпероксиды:
4Li + O2 = 2 Li2O (оксид лития)
2 Na + O2 = Na2O2 (пероксид натрия)
K + O2 = KO2 (надпероксид калия)
Na2O2 + 2Na = 2Na2O
Оксиды натрия и других щелочных металлов получают из пероксидов:
Na2O2 + 2Na = 2Na2O.
Щелочные металлы и их соединения способны окрашивать пламя: в малиновый цвет (литий), в желтый (натрий), в сине-фиолетовый (каолий), в темно-красный (рубидий), в голубой (цезий).
Щелочные металлы взаимодействуют:
- с водородом, образуя гидриды 2Na + H2 = 2NaH (гидрид натрия)
- с серой – сульфиды 2K + S = K2S(сульфид калия)
- с галогенами – галогениды 2Li + Cl2 = 2LiCl (хлорид лития)
Щелочные металлы взаимодействуют со сложными веществами
- с водой образуют щелочи 2Na + 2H2O = 2NaOH + H2,
- с кислотами – соли и водород 2Na + 2HCl = 2NaCl + H2
хлорид натрия
- с растворами солей – не вытесняют металлы из растворов солей 2Na + CuSO4 + 2H2O = Cu(OH)2↓ + Na2SO4 + H2
Оксиды щелочных металлов – твердые вещества, обладают свойствами основных оксидов.
Взаимодействуют:
- с водой с образованием щелочей Na2O + H2O = 2NaOH
- с кислотными оксидами с образованием солей K2O + CO2 = K2CO3
- с кислотами с образованием соли и воды Li2O + 2HCL = LiCl + H2O
Физические свойства гидроксидов щелочных металлов: твердые вещества белого цвета хорошо растворимые в воде. Вследствие диссоциации щелочи меняют цвет индикаторов.
| индикатор | цвет индикатора в нейтральной среде | цвет индикатора в щелочной среде |
| лакмус | фиолетовый | синий |
| метилоранж | оранжевый | желтый |
| фенолфталеин | бесцветный | малиновый |
Гидроксиды щелочных металлов обладают всеми свойствами растворимых оснований. Они взаимодействуют:
- с кислотными оксидами2KOH + SO2 = K2SO3 + H2O
- с кислотами, NaOH + HCl = NaCl + H2O
- с растворимыми солями, 2LiOH + CuSO4 = Li2SO4 + Cu(OH)2
- с амфотерными основаниями. 2NaOH + Zn(OH)2 = Na2[Zn(OH)4]
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|