
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Расчетные задачи
Расчетные задачи
1. При анализе окситетрациклина было найдено удельное вращение – 1880 при значении угла вращения – 1,880. Рассчитайте концентрацию окситетрациклина в растворе. Толщина слоя жидкости 1 дм.

2. При количественном анализе методом рефрактометрии раствора состава Na Cалицилат -5,0, CaCl2 – 2,0 вода – 100мл, получен результат 1,3458, при титровании CaCl2 методом комплексонометрии получен результат 2,06%. Проведите расчеты результатов, сделайте вывод о соответствии нормам отклонений для компонентов данного раствора. F(NaCал) = 0,0019, F (CaCl2) = 0,00167, доп.отклонения для 5,0 ± 4%, для 2,0 ± 5%.
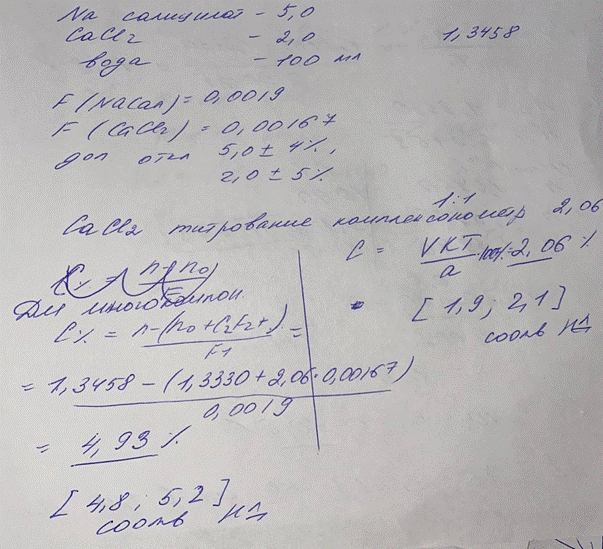
3. При количественном анализе методом рефрактометрии раствора состава: кислота
аскорбиновая 2,0, глюкоза 5,0, вода 100 мл, получен результат 1,3437, при титровании
аскорбиновой кислоты получен результат 2,08%. Проведите расчеты результатов анализа, сделайте вывод о соответствии нормам отклонений для компонентов данного раствора. F(аск.к-ты) = 0,00160, F (глюк) = 0,00142, доп.отклонения для 5,0 ± 4%, для 2,0 ± 5%.

4. При количественном анализе методом рефрактометрии раствора натрия гидрокарбоната 8% получен результат 1,3465. Проведите расчеты результатов анализа двумя способами, сделайте вывод о возможности использования данного раствора. (F = 0,00125, доп.отклонения для 8,0 ± 3%)
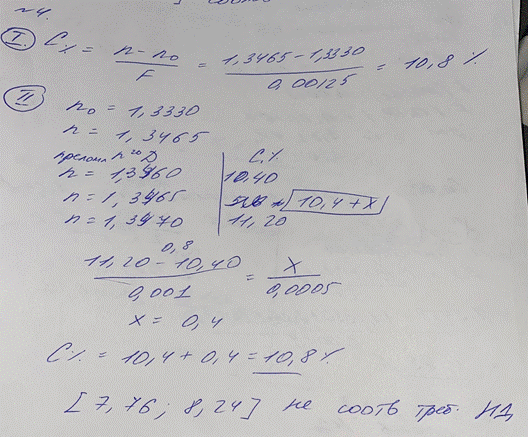
5. При количественном анализе методом рефрактометрии 40% спиртового раствора
борной кислоты 3% получен результат 1,3363 показатель спирта 40% 1,3342. Проведите
расчеты результатов анализа, сделайте вывод о возможности использования данного
раствора, укажите особенности определения спиртовых растворов с концентрацией более 50%. (F = 0,00068, доп.отклонения для 3,0 ± 4%)
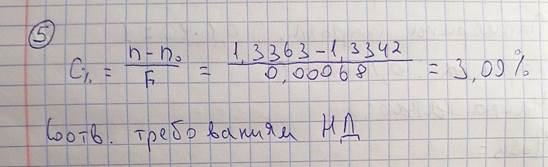
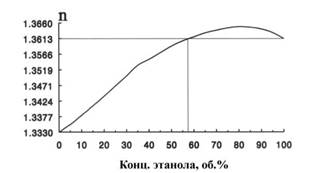
При концентрациях более 60% показатель преломления изменяется очень незначительно, а при содержании этанола около 80% наблюдается точка максимума, и при дальнейшем увеличении концентрации показатель преломления уменьшается. Важно отметить, что при содержании спирта 58% и выше (кроме точки максимума) одному показателю преломления соответствуют две различные концентрации спирта.
Поэтому рефрактометрический анализ водно-спиртовых растворов с целью определения концентрации спирта проводят при содержании этанола до 50%, а более концентрированные растворы перед измерением показателя преломления разбавляют или анализируют по плотности.
6. При количественном анализе методом рефрактометрии раствора сульфацила-натрия 10% получен результат 1,3528 . Проведите расчеты результатов анализа двумя способами, сделайте вывод о соответствии концентрации данного раствора. (F = 0,00198, доп.отклонения для 10,0 ± 3%) СПРОСИТЬ N ДЛЯ СУЛЬФАЦИЛА НАТРИЯ
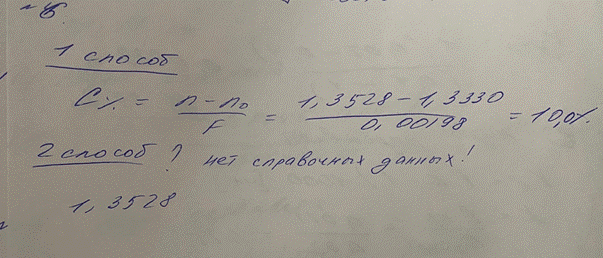
7. Показатель преломления камфорного спирта при 20°С равен 1,3730. Рассчитайте
содержание камфоры в камфорном спирте, если показатель преломления 70% этилового спирта при 20°С равен 1,3640, а фактор показателя преломления камфоры 0,0009
X%=n-n₀ = 1,3730-1,3640 = 10%
F 0,0009
8. В лаборатории готовили титрованный 0,1 М раствор NaOH. В ходе установления титра выяснилось, что фактическая молярная концентрация натрия гидроксида натрия
гидроксида в растворе составляет 0,113 моль/л. Нужно ли проводить разбавление или
укрепление раствора? Рассчитайте объем воды или 1 М раствора натрия гидроксида для разбавления или укрепления раствора, соответственно, если это требуется.
K = 0,113/0.1 = 1,13 → разбавляем
Vразб = (1,13-1)*1000 = 130 мл воды

9. В лаборатории готовили титрованный 0,1 М раствор NaNO2. В ходе установления титра выяснилось, что фактическая молярная концентрация натрия нитрита в растворе составляет 0,02 моль/л. Нужно ли проводить разбавление или укрепление раствора? Рассчитайте объем воды или 1 М раствора натрия нитрита для разбавления или укрепления раствора, соответственно, если это требуется.

10. В лаборатории готовили титрованный 0,02 М раствор KMnO4. В ходе установления
титра выяснилось, что фактическая молярная концентрация калия перманганата в растворе составляет 0,025 моль/л. Нужно ли проводить разбавление или укрепление раствора? Рассчитайте объем воды или 0,2 М раствора калия перманганата для разбавления или укрепления раствора, соответственно, если это требуется.
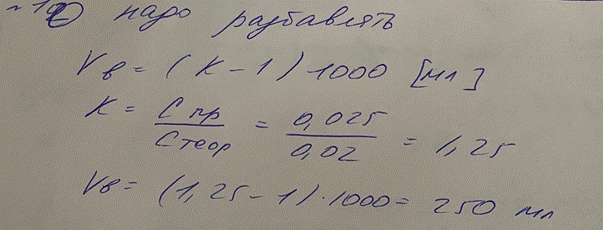
11. В лаборатории готовили титрованный 0,05 М раствор ЭДТА. В ходе установления титра выяснилось, что фактическая молярная концентрация трилона Б в растворе составляет 0,056 моль/л. Нужно ли проводить разбавление или укрепление раствора? Рассчитайте объем воды или 0,5 М раствора трилона Б для разбавления или укрепления раствора, соответственно, если это требуется.
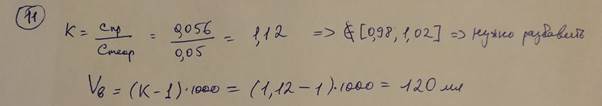
12. В лаборатории готовили титрованный 0,05 М раствор I2. В ходе установления титра
выяснилось, что фактическая молярная концентрация йода в растворе составляет 0,045
моль/л. Нужно ли проводить разбавление или укрепление раствора? Рассчитайте объем
воды или 0,5 М раствора йода для разбавления или укрепления раствора, соответственно, если это требуется.
K = 0,045/0,05 = 0,9 → укрепляем
V = (0,045-0,05)/(0,05-0,5) = 11,11 мл 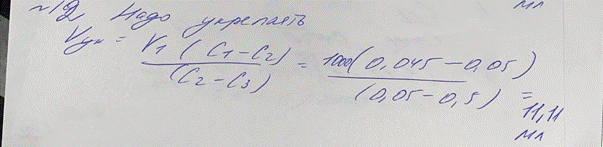
13. В лаборатории готовили титрованный 0,01 М раствор NH4SCN. В ходе установления титра выяснилось, что фактическая молярная концентрация роданида аммония в растворе составляет 0,009 моль/л. Нужно ли проводить разбавление или укрепление раствора?
Рассчитайте объем воды или 0,1 М раствора роданида аммония для разбавления или
укрепления раствора, соответственно, если это требуется.

14. В лаборатории готовили титрованный 0,005 М раствор Na2S2O3. В ходе установления титра выяснилось, что фактическая молярная концентрация натрия тиосульфата в растворе составляет 0,0045 моль/л. Нужно ли проводить разбавление или укрепление раствора? Рассчитайте объем воды или 0,05 М раствора натрия тиосульфата для разбавления или укрепления раствора, соответственно, если это требуется.
K = Cпр/Стеор
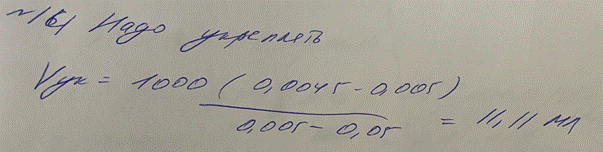
15. В лаборатории готовили титрованный 0, 5 М раствор HCl. В ходе установления титра выяснилось, что фактическая молярная концентрация хлористоводородной кислоты в растворе составляет 0,6 моль/л. Нужно ли проводить разбавление или укрепление раствора? Рассчитайте объем воды или 5 М раствора хлористоводородной кислоты для разбавления или укрепления раствора, соответственно, если это требуется.
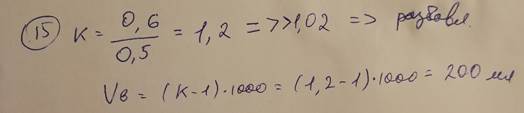
K = Cпр/Стеор
16. В лаборатории готовили титрованный 0, 1 М раствор HClO4. В ходе установления титра выяснилось, что фактическая молярная концентрация кислоты хлорной в растворе составляет 0,11 моль/л. Нужно ли проводить разбавление или укрепление раствора? Рассчитайте объем воды или 1 М раствора кислоты хлорной для разбавления или укрепления раствора, соответственно, если это требуется.
K = 0,11/0,1 = 1,1 → разбавляем
V = (k-1)*1000 = 0,1*1000 = 100 мл воды
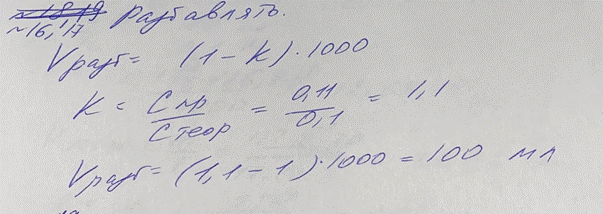
17. В лаборатории готовили титрованный 0, 1 М раствор HClO4. В ходе установления титра выяснилось, что фактическая молярная концентрация кислоты хлорной в растворе составляет 0,11 моль/л. Нужно ли проводить разбавление или укрепление раствора? Рассчитайте объем воды или 1 М раствора кислоты хлорной для разбавления или укрепления раствора, соответственно, если это требуется.

18. Проводили определение поправочного коэффициента титрованного 0,1 М раствора
аммония тиоцианата. На титрование раствора серебра нитрата было потрачено 25 мл
раствора аммония тиоцианата. Напишите способ определения поправочного
коэффициента, уравнения реакций, рассчитайте титриметрический фактор пересчета и
теоретический объем титранта. Определите поправочный коэффициент, сделайте вывод о необходимости разбавления или разведения титрованного раствора. Определите объем воды или 1 М раствора тиоцианата аммония для разбавления или укрепления раствора соответственно.
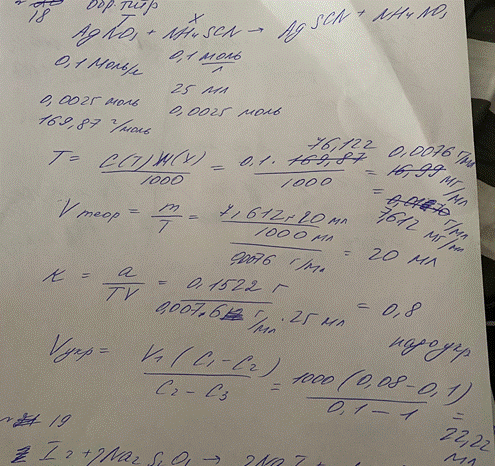
19. Проводили определение поправочного коэффициента титрованного 0,5 М раствора
йода. На титрование раствора йода было потрачено 19 мл раствора натрия тиосульфата.
Напишите способ определения поправочного коэффициента, уравнения реакций,
рассчитайте титриметрический фактор пересчета и теоретический объем титранта.
Определите поправочный коэффициент, сделайте вывод о необходимости разбавления или разведения титрованного раствора. Определите объем воды или 1 М раствора йода для разбавления или укрепления раствора соответственно.
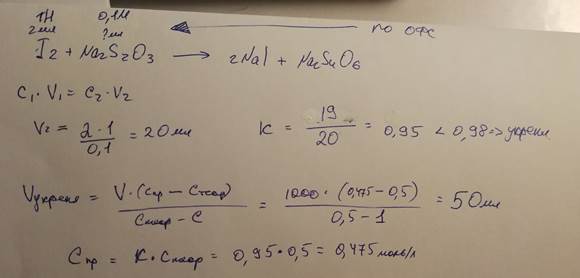
Т-Na2S2O3 X-I2
T=c(Т)*M(Х)/1000=c(Na2S2O3)*M(½ I2)/1000=0.1*126.9/1000=0.01269г/мл
20. Проводили определение поправочного коэффициента титрованного 0,1 М раствора
калия гидроксида. На титрование потрачено 25 мл раствора хлористоводородной кислоты. Напишите способ определения поправочного коэффициента, уравнения реакций, рассчитайте титриметрический фактор пересчета и теоретический объем титранта. Определите поправочный коэффициент, сделайте вывод о необходимости разбавления или разведения титрованного раствора. Определите объем воды или 1 М раствора калия гидроксида для разбавления или укрепления раствора соответственно.
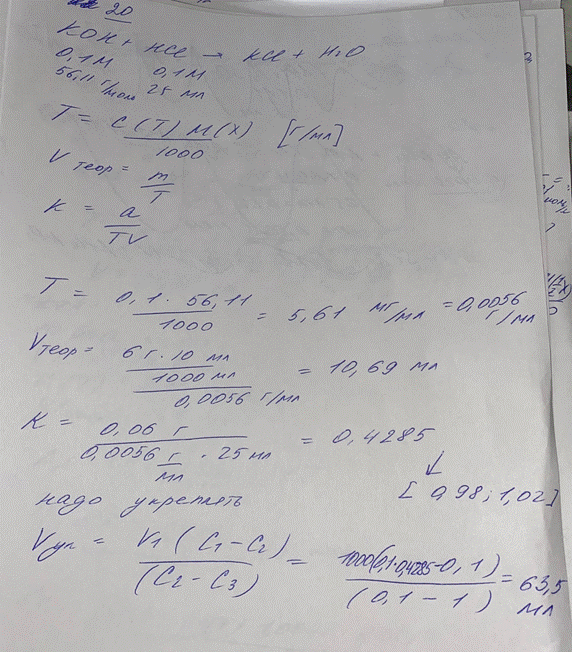
21. Проводили определение поправочного коэффициента титрованного 0,5 М раствора
натрия гидроксида. На титрование раствора хлористоводородной кислоты потрачено 4 мл раствора натрия гидроксида. Напишите способ определения поправочного коэффициента, уравнения реакций, рассчитайте титриметрический фактор пересчета и теоретический объем титранта. Определите поправочный коэффициент, сделайте вывод о необходимости разбавления или разведения титрованного раствора. Определите объем воды или 5 М раствора натрия гидроксида для разбавления или укрепления раствора соответственно.

22. Проводили определение поправочного коэффициента титрованного 0,5 М раствора
хлористоводородной кислоты. На титрование потрачено 26 мл раствора
хлористоводородной кислоты. Напишите способ определения поправочного
коэффициента, уравнения реакций, рассчитайте титриметрический фактор пересчета и
теоретический объем титранта. Определите поправочный коэффициент, сделайте вывод о необходимости разбавления или разведения титрованного раствора. Определите объем воды или 5 М раствора хлористоводородной кислоты для разбавления или укрепления раствора соответственно.
23. Сколько мл раствора калия перманганата 0,02 М КМnО4 с К 1,0000 израсходуется на титрование 1 мл 3% раствора пероксида водорода? М.м. пероксида водорода 34,01
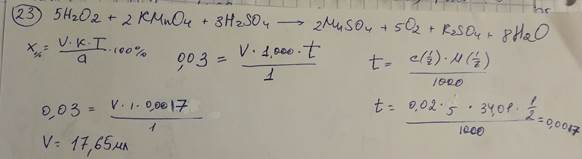
24. На титрование 1,012 г раствора водорода пероксида израсходовалось 17,9 мл
раствора калия перманганата (0,02 моль/л) с К 1,0002. Объем титранта, ушедшего на
контрольный опыт, составил 0,1 мл. Определение проводили согласно методике:
Около 1,0 г (точная навеска) субстанции помещают в мерную колбу вместимостью 100 мл, доводят объём раствора водой до метки и перемешивают. К 10,0 мл полученного раствора прибавляют 5 мл серной кислоты разведенной 16 % и титруют 0,02 М раствором калия перманганата до слабо розового окрашивания. Параллельно проводят контрольный опыт.
1 мл 0,02 М раствора калия перманганата соответствует 1,701 мг водорода пероксида
Н2О2.
Рассчитайте процентную концентрацию пероксида водорода в растворе.
W = (V-Vк)* KT/a *100% = (17,9-0,1)*1,0002*0,01701/1,012 *100 =2,99%
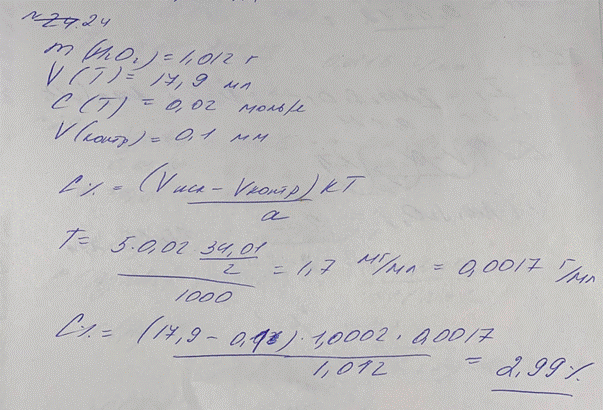
25. Какую навеску 3% раствора пероксида водорода в мл нужно взять, чтобы на
титрование израсходовалось 26,45 мл раствора калия перманганата 0,02 М КМnО4 с К
1,0000?
26. Какой объем раствора натрия тиосульфата (0,1 молъ/л) израсходуется на титрование 0,2000 г субстанции йода согласно методике: Около 0,2 г (точная навеска) растертой субстанции помещают в колбу с притертой пробкой с 10 мл 10 % раствора калия йодида, прибавляют 10 мл воды и титруют 0,1 М раствором натрия тиосульфата до обесцвечивания (индикатор – 1 мл 1 % раствора крахмала).
Параллельно проводят контрольный опыт. 1 мл 0,1 М раствора натрия тиосульфата соответствует 12,69 мг йода I2.
I2+2Na2S2O3 = 2NaI + Na2S4O6
V(Na2S2O3) = m (I2) / C(1/z Na2S2O3) * M(1/z I2)
V(Na2S2O3) = 0.2 / 0.1 * (253.8/2) = 15.76 мл
27. Какой объем раствора натрия гидроксида (0,1 моль/л) с К 1,0000 израсходуется на титрование кислоты борной согласно методике: К около 1 г (точная навеска) субстанции прибавляют 100 мл 20% раствора маннита, предварительно нейтрализованного по фенолфталеину 0,1 М раствором натрия гидроксида, нагревают до полного растворения, охлаждают и титруют 1 М раствором натрия гидроксида с тем же индикатором до появления неисчезающего розового окрашивания. Параллельно проводят контрольный опыт.
1 мл 1 М раствора натрия гидроксида соответствует 61,83 мг борной
кислоты H3BO3.
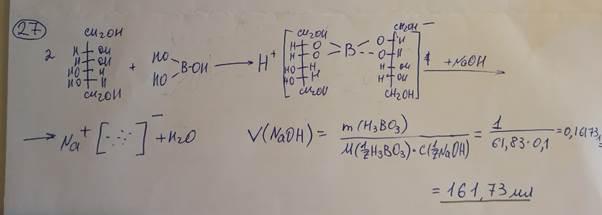
28. На титрование 0,1003 г висмута нитрата основного было израсходовано 7,00 мл раствора трилона Б (0,05моль/л) с К 1,0000. Сделайте заключение о качестве пре-
парата, если, согласно ФС, содержание висмута оксида должно быть 79-82%.
W = VKT/a = 7*1*0,01165/0,1003 = 81.3%
Т = 0,05/2 *465,96 /1000 = 0,01165
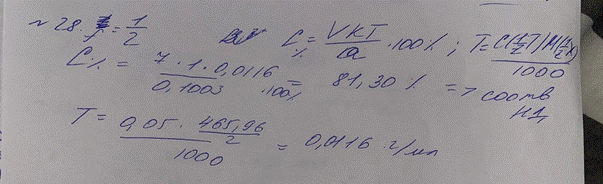
29. Сколько мл раствора серебра нитрата (0,05 моль/л) с К 1,0000 израсходуется
на титрование 0,0500 г натрия хлорида. М.м. натрия хлорида 58,44.

30. Раствора цинка сульфата 0,25% -10,0 мл
Кислоты борной 0,2
Какой объем раствора трилона Б (0,01 моль/л) с К 1,0000 израсходуется на титрование 2 мл препарата? М.м. цинка сульфата 287,54. М.м. кислоты борной 61,83.
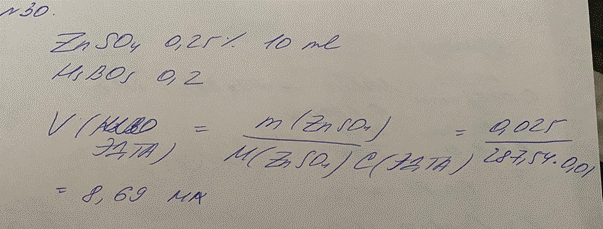
31. Проводили количественное определение магния сульфата, раствора для инъекций 25%, согласно методике: Объём препарата, эквивалентный 1,0–1,25 г магния сульфата, помещают в мерную колбу вместимостью 250 мл и доводят объем раствора водой до метки. К 50,0 мл полученного раствора прибавляют 5 мл аммония хлорида буферного раствора pH 10,0 и титруют при энергичном перемешивании 0,05 М раствором натрия эдетата до синего окрашивания (индикатор – 7 капель раствора эриохрома черного Т).
Параллельно проводят контрольный опыт. 1 мл 0,05 М раствора натрия эдетата соответствует 12,23 мг магния сульфата MgSO4∙7H2O. Для анализа отобрали 5 мл раствора. На титрование препарата было израсходовано 20,8 мл
0,05 М раствора натрия эдетата (К = 1,0000), на контрольный опыт – 0,2 мл.
Сделайте заключение о качестве препарата, если согласно требованию ГФ, он должен
содержать не менее 90,0 % и не более 110,0 % от заявленного количества магния сульфата MgSO4∙7H2O
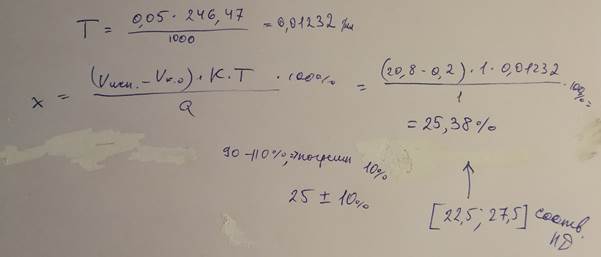
32. Рассчитайте удельное вращение 10% спиртового раствора камфоры, если угол
вращения равен -8°, толщина слоя 20 см.
[α] = α*100/С*l = -8*100/10*2 = -40°
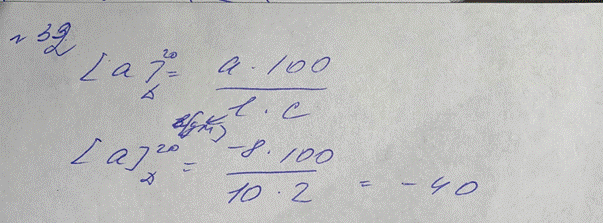
33. Рассчитайте удельное вращение 10% спиртового раствора ментола, если угол
вращения равен -9,8°, толщина слоя 20 см.

34. Рассчитайте концентрацию камфоры в растворе, если угол вращения равен
+8°, толщина слоя 2 дм, величина удельного вращения составляет + 44°.

35. Рассчитайте концентрацию ментола в растворе, если угол вращения равен -
1,8°, толщина слоя 9 см, величина удельного вращения составляет - 50°
[α] = α×1000 = -1,8×1000 = -50 С=4
l×C 9×С
36. Рассчитайте теоретический объем титранта для количественного определения
субстанции парацетомола согласно методике:
Около 0,25 г (точная навеска) субстанции кипятят с обратным холодильником с 10 мл 50% раствора серной кислоты в течение 1 ч.
Холодильник промывают 30 мл воды, объём раствора доводят водой до 80 мл, прибавляют 1,0 г калия бромида и титруют нитритометрически (ОФС «Нитритометрия»).
Конец титрования устанавливают по йодкрахмальной бумаге.
1 мл 0,1 М раствора натрия нитрита соответствует 15,12 мг парацетамола C8H9NO2.
Напишите уравнения реакций.
Vтеор = а/Т = 0,25/0,01512 = 16,53 мл
37. Рассчитайте процентное содержание кальция хлорида гексагидрата в субстанции, если на титрование было израсходовано 18,5 мл раствора трилона Б (0,05 моль/л) с К 1,0000. На титрование контрольного опыта – 0,2 мл. М.м. кальция хлорида гексагидрата 219,08. Напишите уравнения реакций.
Около 0,8 г (точная навеска) субстанции помещают в мерную колбу вместимостью 100 мл, растворяют в воде и доводят объем раствора водой до метки. К 25,0 мл приготовленного раствора прибавляют 5 мл аммония хлорида буферного раствора рН 10,0, 0,1 г хромового темно-синего индикаторной смеси или 0,15 мл хромового темно-синего раствора и титруют 0,05 М раствором натрия эдетата до сине-фиолетового окрашивания.
1 мл 0,05 М раствора натрия эдетата соответствует 10,95 мг СаСl2 ∙ 6Н2О.

|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|