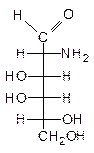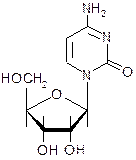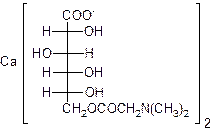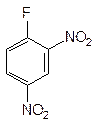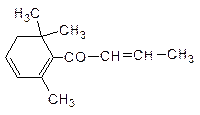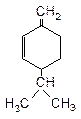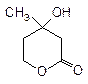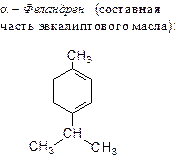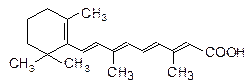- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Вопросы к экзамену по органической химии
Вопросы к экзамену по органической химии
1. Предмет органической химии. Состав органических веществ, их особенности и многообразие. Место органической химии в системе естественных наук, ее научное и практическое значение.
2. Классификация органических соединений. Основные признаки: скелет молекулы, степень насыщенности, наличие функциональных групп. Важнейшие функциональные группы и соответствующие им классы соединений. Гомологи, гомологический ряд.
3. Общие принципы построения названий органических соединений. Современная международная номенклатура IUPAC (заместительная и радикально-функциональная).
4. Основы современной теории строения органических соединений. Теория химического строения А.М. Бутлерова, ее развитие на основе квантовомеханических представлений о строении атома и природе химической связи.
5. Гибридизация атомных орбиталей (sp3, sp2, sp). Строение атомов углерода, азота, кислорода в различных гибридизованных состояниях. Двойная и тройная связи. Атомно-орбитальные модели.
6. Типы химической связи в органических соединениях: ионная, ковалентная, донорно-акцепторная, водородная. Строение s- и p-связей и их особенности. Делокализованные связи.
7. Обменный и донорно-акцепторный механизмы образования связи. Кислоты и основания Льюиса. Гомо- и гетеролитический разрыв связи.
8. Взаимное влияние атомов в молекулах, ионах, радикалах.Электронные эффекты: индуктивный и мезомерный. Эффект сверхсопряжения. Cтерические эффекты.
9. Явление изомерии в органической химии. Разновидности структурной и пространственной изомерии. Влияние пространственного строения органических соединений на их биологическую активность.
10. Энантиомерия. Свойства энантиомеров. Рацематы. Проекционные формулы Фишера. Абсолютная и относительная конфигурация энантиомеров. R,S- и D,L-номенклатуры. Примеры проявления энантиомерии в природе.
11. Диастереомерия. s-, p-Диастереомеры. цис-транс-Изомерия. Z,E-номенклатура. Примеры проявления диастереомерии в природных соединениях.
12. Явление таутомерии в органической химии. Примеры. Роль в природе.
13. Конформация и конформационные изомеры. Проекционные формулы Ньюмена. Конформации алифатических соединений (этан, бутан, длинноцепные молекулы). Гибкость макромолекул. Конформации алициклических соединений (циклогексан, природные гетероциклы).
14. Понятие о механизме реакции. Реагент, субстрат, реакционный центр, интермедиат. Энергия активации, переходное состояние.
15. Типы реагентов (радикалы, электрофилы, нуклеофилы). Характеристика основных интермедиатов органических реакций. Свободные радикалы, карбокатионы, карбанионы.
16. Классификация органических реакций по направлению и по механизму. Примеры. Понятие о региоселективности, хемоселективности, стереоселективности.
17. Факторы, определяющие направление реакции (статический, динамический). Кинетический и термодинамический контроль продуктов реакции.
18. Научное и практическое значение углеводородов. Роль углеводородного сырья. Классификация углеводородов по строению углеродной цепи и степени ненасыщенности.
19. Номенклатура и изомерия алканов, алкенов, алкинов, циклоалканов, аренов.
20. Свойства алканов: крекинг, изомеризация, дегидрирование, окисление, замещение. Хлорирование (свободно-радикальный характер процесса). Различия в легкости замещения при первичном, вторичном и третичном атомах углерода.
21. Образование двойной углерод-углеродной связи путем дегидрогалогенирования, дегидратацией спиртов: направленность элиминирования. Правило Зайцева.
22. Свойства алкенов: восстановление (гидрирование) и окисление (образование гликолей, эпоксидирование, озонолиз).
23. Присоединение к алкенам галогенов, галогеноводородов, гидратация. Механизм электрофильного присоединения. Относительная стабильность первичных, вторичных и третичных карбокатионов. Правило Марковникова.
24. Присоединение против правила Марковникова. Радикальное и электрофильное присоединение к алкенам. Полимеризация алкенов. Полиэтилен, полипропилен, полиизобутилен.
25. Углеводороды с сопряженными двойными связями: бутадиен, изопрен. Их строение, способность к 1,2- и 1,4-присоединению. Реакция Дильса-Альдера. Полимеризация. Пространственные полимеры. Строение натурального каучука, терпенов (изопреноидов), стероидов.
26. Реакции присоединения к тройной углерод-углеродной связи: гидрирование, галогенирование, гидрогалогенирование, гидратация (Кучеров).
27. СН-Кислотность ацетилена. Реакции ацетиленового атома водорода: замещение на металл, конденсация алкинов-1 с альдегидами и кетонами.
28. Циклоалканы. Сравнение устойчивости их цикла в зависимости от размеров кольца. Различия в химических свойствах "малых" и "нормальных" циклов. Циклогексан: реакции дегидрирования и замещения.
29. Конформации циклогексановых колец. Форма «кресло», аксиальное и экваториальное положение заместителей. Изомерия дизамещенных циклогексанов.
30. Строение бензола. Условия ароматического состояния. Правило Хюккеля. Механизм электрофильного замещения в ароматическом ядре. Галогенирование, нитрование, сульфирование, алкилирование, ацилирование ароматического ядра.
31. Влияние электронодонорных и электроноакцепторных заместителей на скорость и направление реакции электрофильного замещения в ароматическом ряду. Правила ориентации.
32. Галогенирование бензола и его гомологов. Хлорирование толуола в ядро и в боковую цепь (механизм, условия).
33. Нуклеофильное замещение у насыщенного атома углерода. Основные характеристики SN1- и SN2-процессов. Моно- и бимолекулярный механизм реакции.
34. Влияние характера и положения заместителей в ядре арилгалогенидов на реакционную способность связи углерод-галоген в реакциях нуклеофильного замещения. Реактив Сэнгера для установления аминокислотного состава белков.
35. Дегидрогалогенирование алкилгалогенидов. Направленность реакций элиминирования. Конкуренция реакций нуклеофильного замещения и элиминирования.
36. Реакция алкилгалогенидов с металлическим натрием, с магнием. Образование металлорганических соединений. Характер связи углерод-металл..
37. Классификация и изомерия спиртов. Физические свойства (водородная связь). Реакции спиртов: образование алкоголятов, простых и сложных эфиров, замещение гидроксила на галоген (кислотный катализ), дегидратация, окисление.
38. Получение предельных одноатомных спиртов гидратацией алкенов, гидролизом алкилгалогенидов (конкурентность процесса с дегидрогалогенированием), восстановлением альдегидов или кетонов, с помощью магнийорганических соединений.
39. Строение и свойства многоатомных спиртов. Гликоли, их получение из алкенов. Глицерин.
40. Простые эфиры. Их получение и свойства. Этиленоксид и диоксан, сравнение их свойств.
41. Сернистые аналоги спиртов (тиолы). Окисление тиолов. Образование дисульфидов, сульфокислот. Реакции замещения тиольного атома водорода. Сравнение кислотности спиртов и тиолов.
42. Фенолы. Сравнение кислотных свойств фенолов и спиртов. Реакции гидроксила: образование фенолятов, простых и сложных эфиров. Влияние гидроксила на электрофильное замещение в ароматическом ядре фенола. Конденсация с альдегидами.
43. Строение карбонильной группы в альдегидах и кетонах. Реакционные центры в молекулах карбонильных соединений. Механизм нуклеофильного присоединения по карбонильной группе, роль кислотного и основного катализа.
44. Взаимодействие альдегидов и кетонов со спиртами. Полуацетали и ацетали, их отношение к гидролизу, сравнение со свойствами простых эфиров. Роль в природе.
45. Кето-енольная таутомерия. Реакции оксосоединений с участием a-водородного атома: действие галогенов, альдольно-кротоновая конденсация (схема реакции).
46. Реакции по углеводородному радикалу a,b-непредельных и ароматических оксосоединений.
47. Образование альдегидов и кетонов при окислении или дегидрировании спиртов, при гидролизе дигалогенидов, гидратацией алкинов, пиролизом кислот или их солей. Ацилирование ароматического ядра по Фриделю-Крафтсу, роль кислот Льюиса.
48. Строение карбоксильной группы. Реакционные центры в молекулах карбоновых кислот. Функциональные производные карбоновых кислот, их получение и свойства. Ацилирование аминов, спиртов, фенолов.
49. Механизм реакции этерификации. Гидролиз сложных эфиров (сравнение устойчивости простых и сложных эфиров к гидролизу).
50. Образование кислот при окислении углеводородов, спиртов, альдегидов, при гидролизе нитрилов, и других функциональных производных, с помощью магнийорганических соединений.
51. Карбоновые кислоты и их производные в природе. Понятие о строении липидов. Простые липиды, их строение и биологические функции. Физические и химические свойства жиров. Реакция омыления. Гидрирование масел.
52. Дикарбоновые кислоты. Отношение к нагреванию щавелевой, малоновой, янтарной, глутаровой и малеиновой кислот (декарбоксилирование, дегидратация). Образование циклических ангидридов. Адипиновая, фталевая и терефталевая кислоты.
53. Непредельные карбоновые кислоты. Ориентация при реакциях присоединения к двойной связи углерод-углерод у сопряженных непредельных кислот. Использование акриловой и метакриловой кислот и их производных для получения полимеров.
54. Гидроксикислоты. Различие в направлении дегидратации a-, b- и l-гидроксикислот. Лактиды, лактоны. Полиэфиры. Гликолевая, молочная, яблочная, лимонная, винные кислоты (строение, нахождение в природе).
55. Альдегидо- и кетонокислоты. Пировиноградная кислота: ее образование из молочной кислоты, декарбоксилирование, декарбонилирование, превращение в аланин. Ацетоуксусная кислота.
56. Углеводы. Классификация и изомерия моносахаридов. Строение глюкозы, фруктозы, рибозы, дезоксирибозы. Связь конфигурации сахаров с геометрией глицеринового альдегида.
57. Цикло-оксо-таутомерия и мутаротация сахаров. Гликозидный гидроксил. Конформация и конфигурация циклических форм на примере глюкозы и рибозы.
58. Реакции альдоз: окисление, восстановление, алкилирование, ацилирование. Фосфаты сахаров в природе. Образование гликозидов.
59. Открытая и циклическая формы D-рибозы и 2-дезокси-D-рибозы. Строение нуклеозидов и нуклеотидов.
60. Олигосахариды. Восстанавливающие и невосстанавливающие дисахариды. Сахароза, ее строение, инверсия оптической активности при гидролизе.
61. Полисахариды. Целлюлоза, ее строение, пути химической переработки. Крахмал, амилоза, амилопектин. Гликоген.
62. Амины, их строение и классификация. Различие основности у алифатических и ароматических аминов. Нуклеофильные свойства аминогруппы. Алкилирование, ацилирование аминов.
63. Действие азотистой кислоты на алифатические амины и ароматические амины (первичные, вторичные, третичные). Азосочетание. Понятие об азокрасителях.
64. Галогенирование, сульфирование, нитрование ароматических аминов (ориентация, защита аминогруппы). Понятие о строении сульфаниламидных препаратов.
65. Методы получения аминов: алкилирование аммиака и аминов, восстановление нитросоединений, амидов, нитрилов, иминов.
66. Аминокислоты. Классификация, изомерия. Стереохимия природных аминокислот. Кислотно-основные свойства a-аминокислот. Сравнение свойств a-, b- и g-аминокислот. Дикетопиперазины. Лактамы. Лактим-лактамная таутомерия. e-Капролактам.
67. Олиго- и полипептиды. Понятие о пептидном синтезе. Строение белков. Протеиды. Ферменты. Полиамиды (поликапролактам).
68. Пятичленные гетероароматические соединения: фуран, тиофен, пиррол. Их строение, свойства. Понятие о строении гемоглобина и хлорофилла.
69. Азотистые гетероароматические соединения: пиридин, имидазол, пиримидин, пурин. Их строение, роль в природе. Сравнение свойств пиридина, пиррола и бензола при электрофильном замещении.
70. Азотистые основания нуклеозидов: производные пиримидина (тимин, урацил, цитозин) и пурина (аденин, гуанин). Лактим-лактамная таутомерия нуклеиновых оснований. Понятие о строении нуклеозидов, нуклеотидов, нуклеиновых кислот.
Задачи по органической химии
1. Первитин(“пробуждающий” медицинский препарат, снимает усталость и повышает работоспособность):
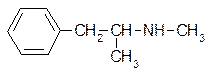
Напишите реакции первитина с а) СН3СОСl без катализатора; б) СН3СОСl в присутствии AlCl3; в) HNO2.
Возможна ли стереоизомерия для первитина?
2. Сфингозин (структурный фрагмент фосфолипидов, содержащихся в нервных тканях, сердце и печени):
СH3(CH2)12CH=CH-CH(OH)-CH(NH2)-CH2OH
Назовите сфингозин по систематической номенклатуре. Возможна ли для этого соединения пространственная изомерия? (Если да, укажите количество и тип стереоизомеров). Напишите уравнение реакции сфингозина с HСl. Какой продукт образуется при взаимодействии сфингозина с азотистой кислотой?
3. Дендролизин - аттрактант муравьев:
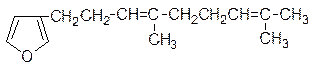
Назовите по систематической номенклатуре. Возможна ли пространственная изомерия для дендролизина ? Напишите реакции дендролизина с а) Br2; б) H2O. Укажите тип этих реакций и возможности стереоизомерии для продуктов.
4. Гомосерин - важный промежуточный продукт обмена веществ, содержится в растительных и животных тканях:
HO-CH2-CH2-CH-COOH
½
NH2
Изобразите стереохимические формулы энантиомеров гомосерина, установите их конфигурацию и постройте проекции Фишера. Какие продукты образуются при нагревании гомосерина?
5. Уридин - структурный фрагмент нуклеиновых кислот:
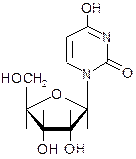 Назовите углеводный фрагмент уридина и укажите его стереохимические параметры. Назовите неуглеводный фрагмент уридина и укажите тип нуклеиновых кислот, в которых он содержится. Напишите реакцию гидролиза уридина и схему таутомерных превращений продуктов гидролиза.
Назовите углеводный фрагмент уридина и укажите его стереохимические параметры. Назовите неуглеводный фрагмент уридина и укажите тип нуклеиновых кислот, в которых он содержится. Напишите реакцию гидролиза уридина и схему таутомерных превращений продуктов гидролиза.
6. Телергон - половой аттрактант пчелинной матки:
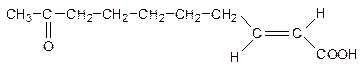
Назовите по систематической номенклатуре (с указанием конфигурации).
Напишите реакции телергона с: а) Н2О (НÅ); б) HCN (OH-); в) NaHSO3; г) C2H5OH (HÅ).
7. Адреналин - гормон мозгового слоя надпочечников:

Укажите электронные эффекты гетероатомов в молекуле адреналина.
Напишите реакции адреналина с а) NaOH, б) HCl, в) HNO2.
8. Мускалур - половой аттрактант самки домашней мухи:

Назовите это соединение по систематической номенклатуре (с указанием конфигурации).
Напишите реакции мускалура с а) HCl, б) Br2, в) KMnO4.
9. Галактозамин - структурный фрагмент природных полисахаридов:
|
|
Изобразите схему таутомерных превращений галактозамина и его реакции с а) HNO2, б) CH3I, в) ROH (HÅ).
10. Сиреневый спирт - соединение, определяющее запах цветов сирени:
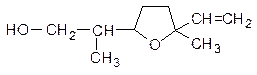
К каким классам органических соединений можно отнести сиреневый спирт? Возможна ли для него пространственная изомерия?
Напишите реакции сиреневого спирта с а) HCl, б) HI, в) O3, затем H2O.
11. В состав каких биологически важных веществ входит в качестве структурного фрагмента следующее соединение:
|
|
Назовите углеводную часть этого соединения, указав ее стереохимические параметры. Что собой представляет неуглеводная часть? Дайте полное название соединения.
Укажите, каким путем можно разделить данное соединение на углеводную и неуглеводную составляющие?
12. Аспарагин - природная аминокислота:
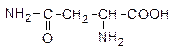
Напишите реакции аспарагина с а) H2O (HÅ), б) H2O (OH-), в) HNO2.
Укажите, какие реакции происходят при биосинтезе аспарагина в растениях:
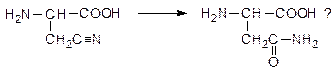
13. Пиретрин - сильный природный инсектицид, получаемый из ромашки:

Сколько стереоизомеров соответствует приведенной формуле? Сколько молекул воды максимально может прореагировать с одной молекулой пиретрина в а) кислой среде, б) щелочной среде?
14. Пангамат кальция - витамин В15:
|
|
К какому стереохимическому ряду относится витамин В15? Назовите продукты гидролиза пангамата кальция в кислой среде.
С помощью каких реакций можно превратить витамин В15 в глюкозу?
15. 2,4-Динитрофторбензол - реагент, применяемый для определения концевых аминокислот в белке (реактив Сэнгера):
|
|
Укажите электронные эффекты в молекуле
2,4-динитрофторбензола.
Напишите реакцию этого соединения с аминокислотой глицином
(укажите тип реакции).
16. Никотин - алкалоид (сильно ядовитое вещество, широко используемое для борьбы с вредными насекомыми):
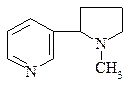 Сравните основность атомов азота. Напишите реакции никотина со следующими реагентами:
Сравните основность атомов азота. Напишите реакции никотина со следующими реагентами:
а) HCl; б) Cl2 при УФ-облучении; в) Cl2 (FeCl3).
17. ДДТ (п,п’- дихлордифенилтрихлорэтан) - контактный инсектицид (в большинстве стран запрещен):
|
|
Напишите реакции хлорирования ДДТ:
а) при УФ-облучении,
б) в присутствии катализатора AlCl3.
Какие типы реакций характерны для 1) Cl-атомов, связанных с циклом; 2) Cl-атомов в CСl3-группе; 3) СН-связей в цикле; 4) CH-связей в боковой цепи?
18.Расшифруйте схему превращений:

Укажите типы реакций. Все соединения назовите.
19. Синтез фенацетина (жаропонижающее медицинское средство) осуществляется по схеме:
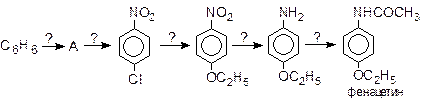
Расшифруйте эту схему и укажите тип реакции для каждой стадии синтеза фенацетина.
20. В высших грибах, сложноцветных и зонтичных растениях встречается углеводород:
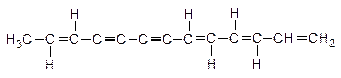
Назовите это соединение по систематической номенклатуре. Установите конфигурацию. Укажите типы реакций, характерных для связей а) двойных, б) тройных.
21. Дамасценон - составная часть розового масла:
|
|
Возможна ли пространственная изомерия для этого соединения?
Укажите электронные эффекты в молекуле дамасценона.
Какой тип конденсации и с участием каких связей возможен для дамасценона?
 |
22. Расшифруйте схему превращений:
23. Сквален - углеводород, выделенный из жира акулы:
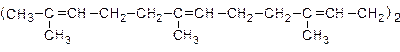
К какой разновидности терпеновых углеводородов относится сквален? Сколько стереоизомеров соответствует приведенной формуле? Укажите тип реакции сквалена с а) Br2 в растворе, б) HBr в присутствии перекиси. Сколько различных соединений образуется при озонолизе сквалена?
24. Пантотеновая кислота - витамин В3 (применяется при нарушении обменных процессов):

Возможна ли для этого соединения пространственная изомерия? Напишите реакцию гидролиза пантотеновой кислоты в кислой среде. Какие вещества образуются при нагревании продуктов гидролиза?
25. b-Феландрен - углеводород, содержащийся в скипидаре сибирской пихты:
|
|
К какой разновидности терпенов относится это соединение? Возможна ли для него пространственная изомерия?
Напишите реакцию b-феландрена с HCl в эквимолекулярных количествах. Какие продукты образуются при озонолизе b-феландрена?
26. Мевалолактон - промежуточное звено при биосинтезе природных веществ изопреноидного строения:
|
|
Возможна ли для него стереоизомерия?
Укажите, какие процессы необходимы для превращения мевалолактона в изопрен:
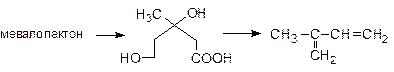
Все соединения назовите по систематической номенклатуре.
27. Бомбикол - аттрактант самки тутового шелкопряда:
CH3CH2-CH=CH-CH=CH-(CH2)8-CH2OH.
Назовите это соединение по систематической номенклатуре. Сколько и каких изомеров может соответствовать данной структурной формуле? Укажите типы реакций, характерные для бомбикола. Какие продукты могут образоваться при взаимодействии бомбикола с малеиновым ангидридом?
|
|
28.
|
|
Назовите эти соединения по систематической номенклатуре. С помощью каких реакций можно получить ментол из a-фелландрена?
29. Яблочная кислота (содержится в яблоках, крыжовнике, барбарисе):
HOOC-CH(OH)-CH2COOH
Назовите по систематической номенклатуре это соединение. Напишите реакцию, происходящую при нагревании яблочной кислоты. Укажите механизм превращения S-яблочной кислоты в R-хлорянтарную под действием PCl5.
30. Исходя из бензола, синтезируйте азокраситель следующего строения:
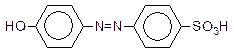
31. Витамин А3 (обнаружен в печени кита):
|
|
Назовите по систематической номен-клатуре с указанием конфигурации.
К какому типу терпеновых соединений можно отнести витамин А3? Какие продукты реакции образуются при восстановительном гидролизе пентаозонида витамина А3? Укажите положения СН-связей в молекуле витамина А3, проявляющих “кислотные” свойства.
32. Наиболее распространенным представителем тиолов в организме является кофермент А (кофермент ацилирования). Наличие тиольной функции отражается в его сокращенном обозначении - KoASH. Напишите реакцию KoASH с уксусной кислотой (образование ацетилкофермента А).
33. К какому типу терпенов (изопреноидов) относится a-фелландрен (составная часть эвкалиптового масла)?
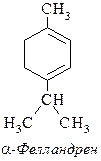
Напишите для a-фелландрена реакции:
а) с НВr; б) с H2O (H+);
б) с кротоновым альдегидом CH3CH=CH-CHO.
34. В группу витаминов B6 (применяются при гепатитах, кожных заболеваниях, токсикозах) входят следующие соединения:
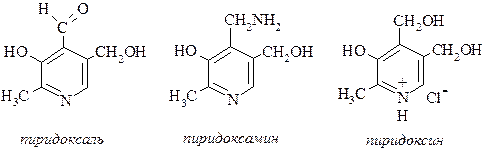
К каким классам органических соединений относятся эти вещества? Укажите реакционные центры, взаимодействующие с реагентами: a) CH3COCl, б) HCl, в) Вr2 в присутствии катализатора (кислоты Льюиса).

|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|