
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Урок 47 Лекция
Изучить материал лекции. Ответить на вопросы после лекции, сфотографировать и выслать ответы мне на почту до 28.04.20.
Моя почта: elenbaff17@mail.ru
Урок 47 Лекция
Тема: «Классификация химических реакций»
Цель: рассмотреть классификацию химических реакций по разным признакам и научиться применять ее при характеристике химических реакций.
Химическая реакция (или химическое явление) – это процесс, в результате которого из одних веществ образуются другие вещества, отличающиеся от исходных по составу или строению, а, следовательно, и по свойствам.
Классификация химических реакций:
1. По числу и составу исходных веществ и продуктов реакции
2. По тепловому эффекту
3. По признаку обратимости
4. По признаку изменения степеней окисления
5. По признаку однородности реакционной системы
6. По наличию катализатора
1. По числу и составу исходных веществ и продуктов реакции:
Реакции соединения — это реакции, в результате которых из двух или нескольких веществ образуется одно новое сложное вещество.
S + O2 = SO2
Реакции разложения — это реакции, в результате которых из одного сложного вещества образуются два или более новых веществ.
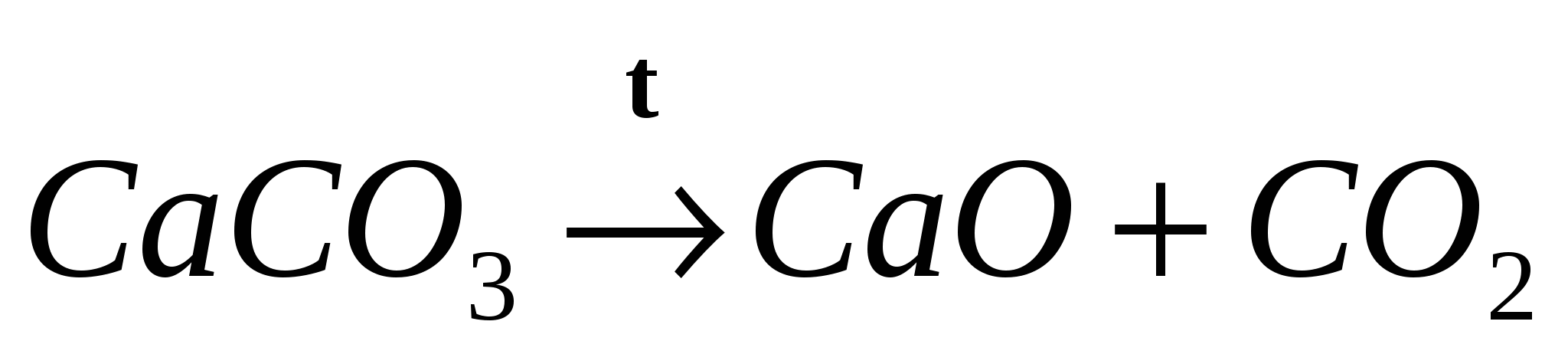
Реакции замещения — это реакции, в результате которых атомы простого вещества замещают атомы одного из химических элементов в сложном веществе.
Zn + 2HCl = ZnCl2 + H2↑
Реакции обмена — это реакции, в результате которых два сложных вещества обмениваются своими составными частями.
AgNO3 + HCl−→−AgCl↓+ HNO3.
2. По тепловому эффекту:
а) Экзотермические реакции - протекают с выделением теплоты
С + O2 = СO2 + Q
б) Эндотермические реакции -протекают с поглощением теплоты
N2 + O2 = 2NO – Q
3. По признаку обратимости:
а) Обратимые реакции -протекают одновременно в двух противоположных направлениях

б) Необратимые реакции - протекают только в одном направлении
Признаки необратимости:
· образование осадка
· образование малодиссоциирующего вещества - слабого электролита,
· выделение газообразного или летучего вещества
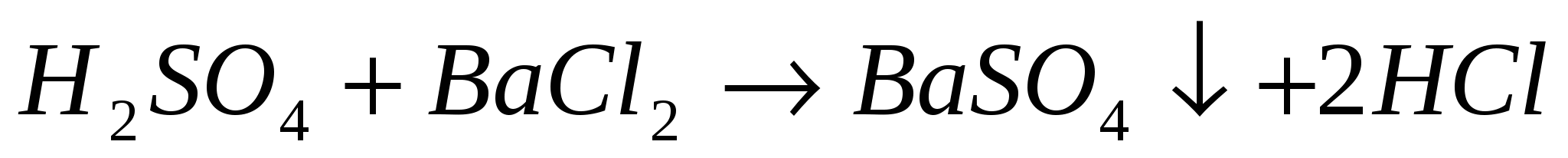
4. По признаку изменения степени окисления:
а) Окислительно – восстановительные реакции протекаютс изменением степени окисления
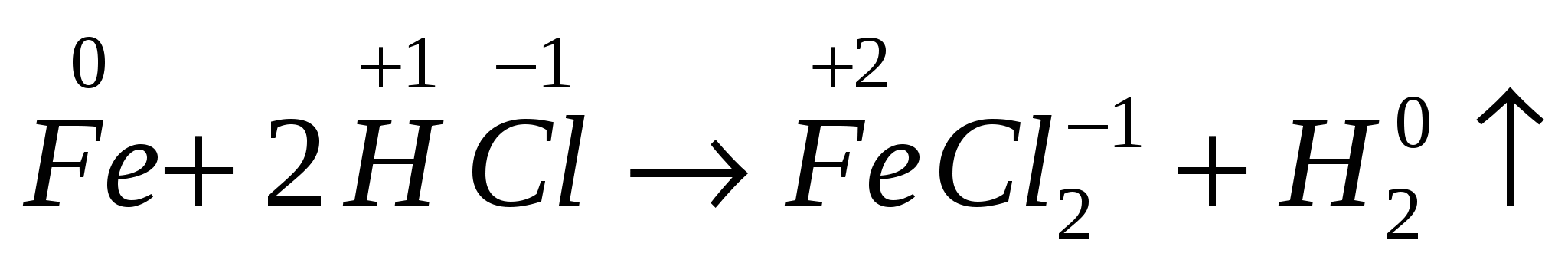
б) Реакции, протекающие без изменения степени окисления элементов
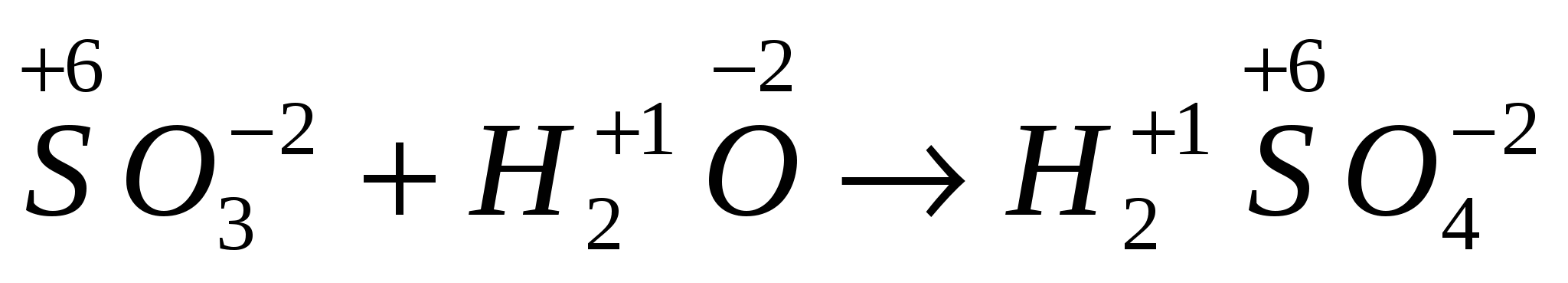
Ответьте на вопросы
1. Какая реакция называется реакцией разложения?
2. Какая реакция называется реакцией замещения?
3. Как называется реакция, протекающая с выделением теплоты?
4. Закончите уравнения химических реакций и укажите их типы:
а) Fe + Cl2 =
б) Ca + HCl =
в) КOH + НCl =
г) Cu(OH)2 =
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|