
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Р а б о т а 8. Опыт 5. Изучение зависимости эдс гальванического элемента из стеклянного и хлорсеребрянного электродов от концентрации ионов водорода. рН-метр-милливольтметр рН-150М, комбинированный электрод ЭСК-10603, магнитная мешалка ПЭ-6110, перемешива
Р а б о т а 8
Опыт 5. Изучение зависимости эдс гальванического элемента из стеклянного и хлорсеребрянного электродов от концентрации ионов водорода
Цель работы –освоение методики измерения разности потенциалов (электродвижущей силы) гальванического элемента из стеклянного и хлорсеребрянного электродов. Изучение зависимости ЭДС электродов от концентрации ионов водорода в исследуемом растворе.
Приборы и оборудование:
рН-метр-милливольтметр рН-150М, комбинированный электрод ЭСК-10603, магнитная мешалка ПЭ-6110, перемешивающий стержень, штатив для электродов, бюретки (3 шт.), промывалка, стаканы химические на 50 мл (5 шт.).
Реактивы:
стандартные буферные растворы, имеющие рН 1,68; 3,56; 4,01; растворы соляной кислоты HCl (0,1; 0,01; 0,001 M).
В работе изучается гальванический элемент, состоящий из стеклянного ионселективного и хлорсеребряного электродов.
Стеклянный электрод является наиболее распространенным ионоселективным электродом. При соприкосновении водного раствора со стеклом, состоящим из силикатов щелочных, щелочноземельных и некоторых других металлов, возможен обмен катионов металла в стекле на ионы водорода из раствора. Благодаря этой реакции на границе контакта «стекло-раствор» возникает скачок потенциала, величина которого зависит от активности Н+ в широком диапазоне изменения рН.
Кроме того, на величину скачка потенциала влияют активности других ионов, принимающих участие в процессе обмена. Так, если мешающими ионами являются ионы Na+, уравнение для скачка потенциала имеет вид
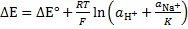 ,
,
где К – константа соответствующей реакции обмена ионов. Для изготовления водород-селективных стеклянных электродов применяют стекла, для которых К>>1. Таким образом, в кислых, нейтральных и слабощелочных средах, когда значение 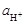 достаточно велико, слагаемым, учитывающим вклад ионов Na+, можно пренебречь, а значит скачок потенциала линейно зависит от логарифма активности Н+,т.е. от рН.
достаточно велико, слагаемым, учитывающим вклад ионов Na+, можно пренебречь, а значит скачок потенциала линейно зависит от логарифма активности Н+,т.е. от рН.
С ростом рН среды влияние ионов Na+ (и других щелочных металлов) усиливается, в результате чего зависимость 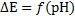 перестает быть линейной. Это отклонение от линейной зависимости в щелочных средах называется щелочной ошибкой стеклянного электрода. Щелочная ошибка растет с ростом температуры. Так, если при температуре до 30 °С она проявляется обычно после рН=9,5, приводя к получению заниженных результатов рН, то при 50 °С отклонения начинаются при рН=8, а при 60 °С – при 5–6. В сильно щелочных средах преобладающим является уже вклад иона щелочного металла, и стеклянный электрод становится не водород-селективным, а металл-селективным электродом. В этой области, использовать стеклянный электрод для определения рН нельзя.
перестает быть линейной. Это отклонение от линейной зависимости в щелочных средах называется щелочной ошибкой стеклянного электрода. Щелочная ошибка растет с ростом температуры. Так, если при температуре до 30 °С она проявляется обычно после рН=9,5, приводя к получению заниженных результатов рН, то при 50 °С отклонения начинаются при рН=8, а при 60 °С – при 5–6. В сильно щелочных средах преобладающим является уже вклад иона щелочного металла, и стеклянный электрод становится не водород-селективным, а металл-селективным электродом. В этой области, использовать стеклянный электрод для определения рН нельзя.
Помимо щелочной ошибки существует и кислотная, противоположная по знаку щелочной. Она в наибольшей степени проявляется в случае кислот с анионами малого размера и, вероятно, связана с адсорбцией анионов. Область, в которой потенциал линейно зависит от рН, называется областью водородной функции стеклянного электрода. В настоящее время разработаны такие стекла, которые позволяют измерять рН стеклянным электродом в области от -2 до +14. Для стеклянных электродов, обычно применяемых в лаборатории, этот диапазон уже и составляет примерно 0–12 (верхний предел указан для растворов с содержанием Na+ не выше 0,1 М).
 | |||
| |||
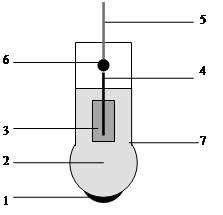
Конструктивно стеклянный электрод представляет собой стеклянную трубку с выдутым на одном конце шариком, который заполнен раствором соляной кислоты с погруженным в нее хлорсеребряным электродом (серебряной проволокой, покрытой слоем труднорастворимой соли AgCl) (рис. 1). Внутренний хлорсеребряный электрод выполняет функцию устройства, осуществляющего смену одних носителей заряда на другие, а именно ионов, обеспечивающих электропроводность стекла, на электроны, играющие ту же роль во внешнем металлическом токоотводе. Смена носителей осуществляется за счет обратимой окислительно-восстановительной реакции
Ag+Cl–→AgCl+ē.
Она отличается высокой скоростью и практически постоянством активностей всех участвующих в процессе веществ. Благодаря этому на границе контакта устанавливается устойчивая и воспроизводимая разность потенциалов.
Хлорсеребряный электрод. В качествеэлектрода сравнения при измерении потенциала исследуемого электрода, разности потенциалов в гальваническом элементе часто используют хлорсеребряный электрод, отличающийся от внутреннего тем, что электролитом для него служит раствор КCl, а не НCl. Достоинствами этого электрода сравнения являются простота эксплуатации и хорошо воспроизводящаяся, стабильная величина электродного потенциала. Последнее обусловлено стабильностью концентрации ионов Ag+ в растворе, заполняющем электрод. Так, в данном случае для системы «раствор - осадок» уравнение закона действующих масс имеет вид
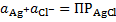 .
.
Отсюда следует, что активность ионов Ag+ будет определяться температурой, влияющей на величину 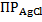 , и активностью ионов Cl–. В случае проведения измерений при комнатной температуре колебания температуры незначительны и слабо влияют на величину ПР. Что же касается концентрации ионов Сl–, то при использовании для заполнения электрода насыщенного раствора KCl, она сохраняет постоянное значение даже при испарении части растворителя, так как избыточное количество KCl в этом случае выпадает в осадок. Дополнительным достоинством насыщенного раствора KCl является низкий диффузионный потенциал на границе контакта «исследуемый раствор – раствор, заполняющий электрод сравнения». Последнее обусловлено близостью подвижностей ионов K+ и Cl– в сочетании с их высокой концентрацией.
, и активностью ионов Cl–. В случае проведения измерений при комнатной температуре колебания температуры незначительны и слабо влияют на величину ПР. Что же касается концентрации ионов Сl–, то при использовании для заполнения электрода насыщенного раствора KCl, она сохраняет постоянное значение даже при испарении части растворителя, так как избыточное количество KCl в этом случае выпадает в осадок. Дополнительным достоинством насыщенного раствора KCl является низкий диффузионный потенциал на границе контакта «исследуемый раствор – раствор, заполняющий электрод сравнения». Последнее обусловлено близостью подвижностей ионов K+ и Cl– в сочетании с их высокой концентрацией.
В настоящей работе используется комбинированный стеклянный электрод, в котором в одном корпусе находится и стеклянный измерительный электрод, потенциал которого зависит от концентрации (активности) ионов водорода и хлорсеребряный электрод сравнения, находящийся в растворе 3М КС1. Так как потенциал хлорсеребряного электрода в 3 М растворе КС1 при 20-25 °С постоянен и равен 0, 224, то ЭДС данного гальванического элемента зависит от потенциала стеклянного электрода и соответственно от концентрации ионов водорода.
Схема гальванического элемента, используемого для определения зависимости ЭДС от концентрации ионов водорода, может быть представлена следующим образом:
Схема гальванического элемента, используемого для определения рН, может быть представлена следующим образом:
Ag│AgClтв; 3 М КCl│стеклянная мембрана│ Н+ ║3М KCl; AgClтв│Ag
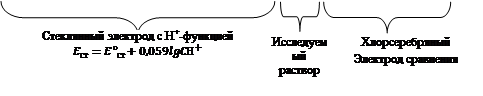
Поскольку сопротивление стеклянной мембраны велико, для измерения ЭДС такого элемента используют высокоомные потенциометры. Применение стеклянного электрода позволяет измерять рН с точностью ±0,01.
Выполнение опыта
1. Ознакомьтесь с измерительной установкой, состоящей из рН-метра и штатива с комбинированным стеклянным электрод, погруженным в стакан с дистиллированной водой.
2. Включите прибор в сеть и прогрейте не менее 10 мин, после чего убедитесь что включен режим измерения электродвижущей силы, «mv».
3. Проверьте правильность работы прибора по контрольному раствору HCl с концентрацией 0,1 М. Значение Е (ЭДС) должно быть равно …. ± 5mv. Для этого осторожно извлеките электрод из стакана, ополосните его дистиллированной водой из промывалки и осушите фильтровальной бумагой. ВНИМАНИЕ! Стеклянный электрод хрупок, поэтому прикасайтесь бумагой к электроду осторожно, стараясь не повредить стеклянную мембрану. Налейте в стакан с надписью «контрольный» раствор и промойте в нем электроды. После этого залейте новую порцию контрольного раствора и определите значение Е (ЭДС).
4. Измерьте Е для остальных стандартных растворов, значения занесите в таблицу.
5. Постройте градуировочный график Е =f(lg C(H+))
6. Получите у преподавателя исследуемый раствор и измерьте для него значение Е.
Оформление опыта
1. Запишите температуру, при которой производились измерения.
2. Внесите результаты в табл. 1.
Таблица 1
Результаты измерений рН с помощью стеклянного электрода
| № п/п | Концентрация стандартного раствора НС1, моль/л | -lg C(H+) | Значение Е, mv |
| 0,1 | |||
| 0,01 | |||
| 0,001 |
3. Постройте градуировочный график зависимости ЭДС от концентрации. Е =f(lg C(H+))
4. Определите концентрацию ионов водорода в исследуемом растворе по градуировочному графику. Результат сравните с истинным значением, полученным у преподавателя.
Контрольные вопросы
1. Теория электролитической диссоциации, сильные электролиты (активность, ионная сила, коэффициент активности),
2. Ионное произведение воды, водородный показатель
3. Электродные процессы; гальванические элементы; электродные потенциалы и ЭДС гальванических элементов;
4. Уравнение Нернста для потенциала электрода и ЭДС гальванического элемента.
5. Электроды (водородный, стеклянный, хлорсеребряный).
6. Ознакомьтесь с потенциометрическим методом определения концентрации/активности потенциалопределяющих ионов.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|