
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Определите температурный коэффициент (g) реакции, если при понижении температуры на 40ºС ее скорость уменьшается в 81 раз.
1. Определите температурный коэффициент (g) реакции, если при понижении температуры на 40ºС ее скорость уменьшается в 81 раз.
Решение:
В области умеренных температур выполняется эмпирическое правило Вант-Гоффа:
g - температурный коэффициент реакции, ∆V – изменение скорости, ∆t – изменение температуры.
∆t = 40ºС; ∆V = 81; g - ?
Формула: 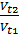 = g
= g 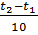
Рассчитываем температурный коэффициент реакции, если при повышении температуры на 40ºС скорость возросла в 256 раз.
Ответ: g = 3.
2. Используя справочные данные для стандартных условий (Т=298 К) рассчитайте ЭДС гальванического элемента, состоящего из титановой и кобальтовой пластин, опущенных в растворы своих солей. Составить схему гальванического элемента.
Решение:
Для расчета ЭДС необходимо рассчитывать потенциаы электродов по уравнению Нернста:
Схема гальванического элемента:
Анод (+) Ti |1 M Ti2+ ||1 M Co2+| Co (-) Катод
Движение электронов во внешней цепи – от анода к катоду, направление электрического тока – противоположное.
Анод: Ti → Ti2++ 2 e- |2| 1 – окисление.
Катод: Co2++ 2 e- → Co |2| 1 – восстановление.
Суммарное уравнение реакции:
Ti + Co2+ → Ti2++Co
E0 = j0кат - j0анод
Е0 = j0(Co2+|Co+) - j0(Ti|Ti2+) = -0,28 – (-1,63) = -1,91 В.
3. В каком направлении в стандартных условиях может протекать реакция:
4NH3(г) + 5O2(г) D 4NO(г) + 6H2O(г)?
Ответ дайте на основании расчетов изменения энергии Гиббса реакции ∆G0298 по значениям стандартных энергий Гиббса ∆f G0298 образования веществ, участвующих в реакции.
Решение:
4NH3(г) + 5O2(г) D 4NO(г) + 6H2O(г)
∆Hх.р. = 4*90,37 – 6*271,83 + 4*46,19 = - 904,74 кДж.
∆Sх.р. = 4*210,2 + 6*188,72 – 4*192,5 – 5*205,03 = 177,97 Дж/моль*к.
∆Gх.р. = - 904,74 – 298*(177,97/1000) = - 957,78 кДж.
Эта реакция при стандартных условиях возможна, так как ∆G 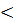 0.
0.
4. К какому типу покрытий относится никелирование меди? Напишите уравнения анодного и катодного процессов и суммарное уравнение коррозии, протекающей во влажном воздухе и сернокислой среде при частичном нарушении этого покрытия.
Решение:
Cu2+ + 2e- → Cu; E0 = 0,35 В.
Ni2+ + 2e- → Ni; E0 = -0,25 B.
A(-) Ni || Cu (+)K.
Во влажном воздухе H2O + O2 деполяризатором служит кислород.
O2 + 2H2O + 4e- → 4OH-
Анодная реакция: Ni0 →Ni2+ + 2e- |2| - окисление.
Катодная реакция: O2 + 2H2O + 4e- → 4OH- |4| - восстановление.
Суммарная реакция: 2Ni + O2 + 2H2O → 2Ni(OH)2
Схема никель-медной гальвопары в среде H2O + O2
Анод(-) Ni | H2O , O2 | Cu (+)Катод , продуктом коррозии является Ni(OH)2.
В серной кислоте возможна коррозия Ni с водородной деполяризацией (-0,25 В 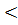 0,00 В
0,00 В 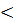 0,35 В):
0,35 В):
Суммарная реакция: Ni + 2H+ → Ni2+ + H2
Анод(-) Ni | H2O , H+ | Cu (+)Катод
Продуктом коррозии – ионы Ni , Ni2+.
5. Расставить коэффициенты в уравнении реакции с помощью электронного баланса:
FeSO4 + K2Cr2O7 + H2SO4 → Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
Решение:
6Fe+2S+6O4-2 + K2+Cr2+2O7-2 + 7H2+S+6O4-2 → 3Fe2+3(S+6O4-2)3+Cr2+3(S+6O4-2)3 + K2+S+6O4-2 + 7H2O
Fe+2 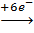 Fe+3 – окисление (восстановитель).
Fe+3 – окисление (восстановитель).
2Cr+7 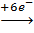 2Cr+3 – восстановление (окислитель).
2Cr+3 – восстановление (окислитель).
FeSO4 – восстановитель, K2Cr2O7 – окислитель.
6. Напишите электронную формулу невозбужденного атома 31Ga. Приведите графическую схему распределения электронов для двух внешних энергетических уровней и определите валентные возможности элемента.
Решение:
+31Ga 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p1
Элемент III А группы, максимальная валентность III. В основном состоянии атом содержит 1 неспаренный p – электрон на внешнем слое, значит число химических свойств в основном состоянии -1.
7. В 250 г воды растворили 10 г неэлектролита. Определить молекулярную массу растворенного вещества, если раствор кипит при 100,226 ºС. (Эбуллиоскопическая константа воды 0,52 К•кг/моль).
Решение:
| m(H2O) = 250г m(неэл.) = 10г t(р-ра) = 100,226 0С K(H2O) =0,52 К•кг/моль M(р-го в-ва) - ? |
∆t = Kэб. – Cm(в-ва)
К(эб.воды) = 0,52
∆t = 100,226 – 100 = 0,226
Cm(в-ва) = ∆t / Kэб. = 0,226 / 0,52 = 0,43 моль/кг
Cm(в-ва) = 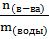 =
= 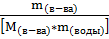
m(H2O) = 0,25 кг
M(в-ва) = 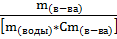 =
= 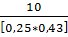 = 93 г/моль.
= 93 г/моль.
Ответ: 93 г/моль.
8. Найдите осмотическое давление при 0 ºС раствора, содержащего в 1 л 18,4 г глицерина С3Н8О3 .
Решение:
n(гл.) = 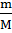 ; n(гл.) =
; n(гл.) = 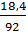 = 0,2 моль
= 0,2 моль
C =  =
= 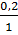 = 0,2 моль/л.
= 0,2 моль/л.
П = C*R*T = 0,2*8,31*273 = 453,8 кПа ≈ 453800 Па.
Ответ: 453800 Па.
9. Вычислите ЭДС гальванического элемента:
Al | Al2(SO4)3 (0,01 M) || SnCl2 (0,1 M) | Sn .
Решение:
Al | Al2(SO4)3 (0,01 M) || SnCl2 (0,1 M) | Sn
По уравнению Нернста : j = j0 + 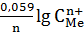
jкат. = j0 Sn2+| Sn + 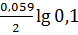 = -0,14 – 0,0295 = -0,17 В.
= -0,14 – 0,0295 = -0,17 В.
jанода = j0 Al3+| Al + 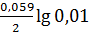 = -1,66 – 0,059 = -1,719 В.
= -1,66 – 0,059 = -1,719 В.
j = jкат. - jанода = -0,17 – (-1,719) = -1,889 В.
Ответ: -1,889 В.
10. Вычислите осмотическое давление раствора, содержащего в 1,4 л 63 г глюкозы С6Н12О6 при 0 ºС.
Решение:
П = С*R*T; m(р-ра) = 140 + 63 = 203 г., то V = 20,3 л.
n = 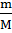 =
= 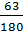 = 0,35 моль.
= 0,35 моль.
С =  =
= 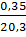 = 0,018 моль/л.
= 0,018 моль/л.
П = 0,018*8,31*(273 + 0) = 40,9 кПа.
Если 63 г С6Н12О6 содержит 1,4 л раствора, то С = 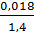 = 0,0128
= 0,0128
П = 0,01*8,31*273 = 29,168 кПа ≈ 29168 Па.
Ответ: 29168 Па.
11. Золь сульфата бария получен реакцией избытка хлорида бария с сульфатом алюминия. Написать формулу мицеллы этого золя.
Решение:
3BaCl2 + Al2(SO4)3 → 3BaSO4↓ +2AlCl3
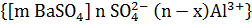 x- * xAl3+
x- * xAl3+
12. К какому типу покрытий относится серебрение железа? Напишите уравнения анодного и катодного процессов и суммарное уравнение коррозии, протекающей во влажном воздухе и сернокислой среде при частичном нарушении этого покрытия.
Решение:
Fe2+ + 2e → Fe, E0= -0,44 B.
Ag+ + e → Ag, E0= 0,80 B.
A(-) Fe || Ag (+)K
Во влажном воздухе Н20 + O2 деполяризатором служит кислород.
O2 + 2H2O + 4e- → 4OH-
Анодная реакция: Fe0 → Fe2+ + 2e- |2| - окисление
Катодная реакция: : O2 + 2H2O + 4e- → 4OH- |4| - восстановление.
Суммарная молекулярная реакция: 2Fe + O2 + 2H2O → 2 Fe(OH)2
Схема железо-серебряной гальванопары в среде H2O + O2:
Анод(-) Fe | H2O , O2 | Ag (+)Катод
Движение электронов во внешней цепи – от анода к катоду, направление электрического тока – противоположное.
В результате продукт коррозии – гидроксид железа (II), который затем подвергается обычному химическому окислению до гидроксида железа (III):
4 Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
В сернокислой среде деполяризующим элементом выступают ионы водорода Н+:
2H+ + 2e- → H2
В серной кислоте возможна коррозия железа с водородной деполяризацией (-0,44 В 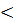 0,00 В
0,00 В 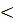 0,80 В)
0,80 В)
Анодная реакция: Fe0 → Fe2+ + 2e- |2| - окисление
Катодная реакция: 2H+ + 2e- → H2 |2| - восстановление
Суммарная молекулярная реакция: Fe + 2H+ → Fe2+ + H2
Схема железно-серебряной гальванопары в кислой среде:
Анод(-) Fe | H2O, H+ | Ag (+)Катод
Движение электронов во внешней цепи – от анода к катоду, направление электрического тока – противоположное.
В результате продукт коррозии – ионы железа (II).
13. Какие коррозионные процессы могут протекать при контакте Cr и Ni а) в растворе HCl б) во влажном грунте? Составьте уравнения анодного и катодного процессов и суммарное уравнение коррозии. Если коррозия невозможна, то объясните почему.
Решение:
Cr3+ + 3e → Cr, E0 = -0,71 B
Ni2+ + e → Ni, E0 = -0,25 B
A(-) Cr || Ni (+)K
а) В растворе HCl дероляризующим элементом выступают ионы водорода Н+:
2Н+ + 2е → Н2
Так как потенциалы хрома и никеля меньше потенциала водородного электрода (-0,71 В 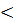 -0,25 В
-0,25 В 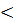 0,00 В), то термодинамически в соляной кислоте возможна коррозия обеих металлов с водородным деполяризатором. Но из-за образования гальванопары преимущественно корродировать будет хром:
0,00 В), то термодинамически в соляной кислоте возможна коррозия обеих металлов с водородным деполяризатором. Но из-за образования гальванопары преимущественно корродировать будет хром:
Анодная реакция: Cr0 → Cr3+ + 3e- |3| - окисление
Катодная реакция: 2Н+ + 2е- → Н2 |2| - восстановление
Суммарная молекулярная реакция: 2Cr + 6H+ → 2Cr2+ + 3H2
Схема никель-хромовой гальванопары в кислой среде:
Анод(-) Cr | H2O , H+ | Ni (+)Катод
Движение электронов во внешней цепи – от анода к катоду, направление электрического тока – противоположное.
В результате продукт коррозии – ионы хрома (III).
б) Во влажной среде Н2O + O2 деполяризатором служит кислород:
O2 + 2H2O + 4e- → 4OH-
Так как потенциалы хрома и никеля меньше потенциала кислородного электрода (-0,71 В 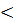 -0,25 В
-0,25 В 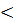 0,82 В), то термодинамически возможна коррозия обоих металлов с кислородным деполяризатором. Но из-за образования гальванопары преимущественно должен был бы корродировать хром.
0,82 В), то термодинамически возможна коррозия обоих металлов с кислородным деполяризатором. Но из-за образования гальванопары преимущественно должен был бы корродировать хром.
В реальных условиях коррозия хрома во влажной среде насыщенной кислородом практически не происходит, так как хром в этих условиях покрыт плотной оксидной пленкой, которая препятствует его дальнейшему окислению. Термодинамически же, без учета оксидной пленки, хром мог бы во влажной почве корродировать:
Анодная реакция: Cr0 → Cr3+ + 3e- |3| - окисление
Катодная реакция: O2 + 2H2O + 4e- → 4OH- |4| - восстановление
Суммарная молекулярная реакция: 4Cr + 3O2 + 6H2O → 4Cr(OH)4
Схема никель-хромовой гальванопары в среде Н2О + О2:
Анод(-) Cr | H2O, O2 | Ni (+)Катод
Движение электронов во внешней цепи – от анода к катоду, направление электрического тока – противоположное.
В результате продукт коррозии – гидроксид хрома (III).
14. Во сколько раз уменьшится скорость реакции:
4HCl + O2 = 2H2O +2Cl2, если уменьшить давление газовой смеси в 3 раза?
Решение:
4HCl + O2 = 2H2O +2Cl2
V1 = K [HCl]4 * [O2]
V2 = K [HCl]4 * 3[O2]
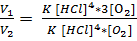 = 3
= 3
Скорость реакции увеличилась в 3 раза.
15. Можно ли использовать KMnO4 в кислой среде для окисления а) H2S до S б) Fe2+ до Fe3+, если:
j (MnO4–/Mn2+) = +1,51 B
j (S/H2S) = +0,17 B
j (Fe3+/ Fe2+) = +0,77 B.
Решение:
Окислительно-восстановительная реакция может идти только в том случае, когда потенциал предполагаемой полуреакции восстановления больше потенциала предполагаемой полуреакции окисления. Сравним потенциалы имеющихся полуреакций.
а) H2S до S:
Реакции восстановления:
MnO4- + 8H+ + 5e- → Mn2+ + 4H2O j0 = +1,51 B
Реакция окисления:
H2S → S + 2H+ + 2e- j0 = +0,17 В
Потенциал полуреакции восстановления больше потенциала полуреакции окисления, поэтому в кислой среде возможна окислительно-восстановительная реакция:
2KMnO4 + 5H2S + 6H+ → 2Mn2+ + 2K+ + 5S + 8H2O
б) Fe2+ до Fe3+:
Реакции восстановления:
MnO4- + 8H+ + 5e- → Mn2+ + 4H2O j0 = +1,51 B
Реакция окисления:
Fe2+ → Fe3+ + 1e- j0 = +0,77 B
Потенциал полуреакции восстановления больше потенциала полуреакции окисления, поэтому в кислой среде возможна окислительно-восстановительная реакция:
KMnO4 + 5Fe2+ + 8H+ → Mn2+ + 2K+ + 5Fe3+ + 4H2O
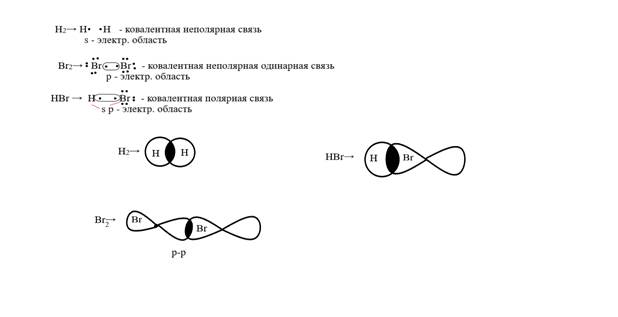
16. Укажите тип химической связи в молекулах Н2, Br2, HBr. Приведите схему перекрывания электронных облаков. В какой из этих молекул связь наиболее полярна и почему?
Решение:
17. Можно ли использовать хлор для окисления а) H2S до S б) Mn2+ до MnO4– , если
j (Сl2/Cl–) = +1,36 В
j (S/H2S) = +0,17 B
j (MnO4–/Mn2+) = +1,51 B.
Решение:
Окислительно-восстановительная реакция может идти только в том случае, когда потенциал предполагаемой полуреакции восстановления больше потенциала предполагаемой полуреакции окисления. Сравним потенциалы имеющихся полуреакций.
а) H2S до S:
Реакции восстановления:
Cl2 + 2e- → 2Cl- j0 = +1,36 В
Реакция окисления:
H2S → S + 2Н+ +2е- j0 = +0,17 В
Потенциал полуреакции восстановления больше потенциала полуреакции окисления, поэтому возможна окислительно-восстановительная реакция:
Cl2 + H2S → 2Cl- + S + 2Н+
б) Mn2+ до MnO4- :
Реакции восстановления:
Cl2 + 2e- → 2Cl- j0 = +1,36 В
Реакция окисления:
Mn2+ + 4Н2О → MnO4- + 8Н+ + 5е- j0 = +1,51 В
Потенциал полуреакции восстановления больше потенциала полуреакции окисления, поэтому невозможна окислительно-восстановительная реакция:
5Cl2 + 2Mn2+ + 8Н2О → 2MnO4- + 16Н+ + 10Cl-
18. В каком направлении в стандартных условиях может протекать реакция:
4Fe2O3(к) + 3CO(г) D 2Fe(к) + 3CO2(г)?
Ответ дайте на основании расчетов изменения энергии Гиббса реакции ∆G0298 по значениям стандартных теплот образования ∆f H0298 и стандартных энтропий S0298 веществ, участвующих в реакции.
Решение:
Изменение энтальпии (тепловой эффект):
∆Н⁰(298 К) = [3∆H⁰(CO2) + 2∆Н⁰(Fe)] - ∆Н⁰(Fe2O3) + 3∆Н⁰(CO)] =
= [3*(-393,5) + 2*0] – [-822,2 + 3*(-110,5)] = -26,8 кДж = -26800 Дж
Изменение энтропии (Кельвин):
∆S = [3S⁰(CO2) + 2S⁰(Fe)] – [S⁰(Fe2O3) + 3S⁰(CO)] = [3*213,7 + 2*0] –
- [87,4 + 3*197,5] = -38,8 Дж/К.
∆G = ∆Н - ∆S*T = -26800 – (-38,8)*900 = 8120 Дж > 0, реакция в прямом направлении.
19. Расставить коэффициенты в уравнении реакции с помощью электронного баланса:
KMnO4 + KI + H2SO4 → MnSO4 + I2 + K2SO4 + H2O
Решение:
2K+Mn+7O4-2 + 10K+I- + H2SO4 → 2Mn+2SO4 + 5I20 + 6K2+SO4 + 8H2O
Mn+7 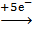 Mn+2 2 - окислитель
Mn+2 2 - окислитель
10
2I- 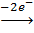 I20 5 - восстановитель
I20 5 - восстановитель
20. Электролиз раствора медного купороса с угольными электродами проводили в течение 1 часа при силе тока 6 А. Каков объем (н.у.) выделившегося на аноде газа? Что и в каком количестве выделилось на катоде?
21. Как изменится скорость реакции, имеющей энергию активации Еа=155 кДж/моль, при увеличении температуры от 350 до 400 К.
Решение:
Согласно уравнению Аррениуса:
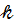 =
= 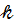 0 *
0 * 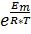
ln 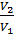 =
= 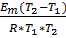 =
= 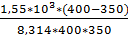 = 6,66
= 6,66
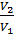 = e6,66 = 780
= e6,66 = 780
Ответ: в 780 раз.
22. Пользуясь графическим изображением молекулы SO2, определите тип гибридизации ее центрального атома и укажите пространственную форму этой молекулы.
Решение:
Для объяснения формы молекул SO2 необходимо определить тип гибридизации АО центрального атома по методу валентных связей.
Атом серы (p – элемент с конфигурацией 1s22s22p63s23p4) в нормальной состоянии имеет два неспаренных электрона на двух р – эрбиталях.
Изменить свою «форму» атомная орбиталь может лишь при возбуждении атома, гибридизируясь с другими атомными орбиталями иной симметрии этого же атома. При образовании молекулы SO2 происходит возбуждение атома серы, в результате которого один электрон переходит с 3 р – подуровня на пустующую орбиталь 3 d – подуровня.
Таким образом, образуются орбитали различного строения, которые при образовании химической связи с неспаренными элетронами атомов кислорода преобразуются в две одинаковые гибридные sp3d – подуровня.
Для определения формы молекулы, воспользуемся методом Гиллеспи.
Четыре электрона атома серы участвуют в образовании двойных связей с двумя атомами кислорода (n=2), следовательно, у центрального атома остается одна неподеленная пара электронов, не принимающих участия в образовании связей (m=1).
Стерический фактор для молекулы SO2 q = n + m = 2 + 1 = 3. Это означает, что образуются три гибридные орбитали, направленные в пространстве к вершинам плоского треугольника под углом около 600 . одна вершина заняты неподеленной электронной парой серы, а две – атомами кислорода. Следовательно, молекула SO2 имеет угловую форму.
В молекуле диоксида серы дипольные моменты связей не компенсируют друг друга (молекула несимметрична), поэтому она полярна.
23. Напишите выражения для скоростей прямой и обратной реакций и для константы равновесия: 2SO3 = 2SO2 + O2; ∆H >0. Как следует изменить в системе а) температуру; б) давление, чтобы сместить равновесие в прямом направлении?
24. Какие коррозионные процессы могут протекать при контакте Cu и Ag а) в растворе H2SO4 с доступом кислорода б) в закрытом сосуде с HCl? Составьте уравнения анодного и катодного процессов и суммарное уравнение коррозии. Если коррозия невозможна, то объясните почему.
25. Составить схему электролиза раствора нитрата натрия с угольными электродами. Какое вещество и какой массой выделилось на катоде, если процесс проводили при силе тока 3 А в течение 2 часов?
Решение:
NaNo3 → Na+ + NO3-
4NaNO3 + 2H2O → 4Na + 4H NO3 + O2↑
m Na = 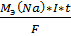 =
= 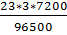 = 5,15 г.
= 5,15 г.
26. Взаимодействие между оксидом углерода (II) идет по уравнению: СО(г) + Cl2(г) = СОCl2(г). Концентрация СО была 0,3 моль/л, Cl2 – 0,2 моль/л. Как изменится скорость прямой реакции, если увеличить концентрацию угарного газа до 2,4 моль/л, а хлора – до 3 моль/л?
Решение:
СО(г) = 2,4 моль/л, Cl2(г) = 3 моль/л
Кинетическое уравнение для исходных условий:
V1 =  *C(CO)*C(Cl2) =
*C(CO)*C(Cl2) =  *0,3*0,2 = 0,06
*0,3*0,2 = 0,06 
Уравнение для измененных условий:
V2 = 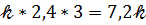
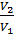 =
= 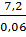 =120
=120
Ответ: 120 раз.
27. Золь бромида свинца (II) получен реакцией бромида кальция и с избытком ацетата свинца. Написать формулу мицеллы этого золя.
При смешивании растворов:
Pb(CH3COO)2 и (CaBr2) протекает реакция, которая приводит к образованию золя:
Pb(CH3COO)2 + CaBr2 → PbBr2↓ + Ca(CH3COO)2
Ядро мицеллы состоит из нерастворенного вещества PbBr2
PbBr2 имеет ионную кристаллическую решетку: Pb2+ и Br-
Ядро: PbBr2
Вещество в избытке: Pb2+СH3COO-
Формула мицеллы будет:
{[m PbBr2] n Pb2+ (n-x) СH3COO-}x- * xСH3COO-
28. Вычислите температуру замерзания раствора, содержащего 30 г глюкозы С6Н12О6 в 200 г воды. (Криоскопическая константа воды 1,86 К•кг/моль).
Решение:
tзам.= K*m; M(С6Н12О6) = 180 г/моль.
n = 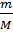 =
= 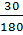 = 0,16 моль
= 0,16 моль
m = 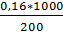 = 0,83 моль/л
= 0,83 моль/л
tзам. = 1,86*0,83=1,55
∆ tзам. = 1,55 ⁰С
Тзам. = Tзам.(Н2О)= 0 ⁰С
Тзам. = Tзам.(Н2О) - ∆Тзам. = 0⁰С – 1,55⁰С = -1,55⁰С (по закону Рауля).
29. В гетерогенной системе установилось равновесие: CaO(к) + Н2О(г) = Са(ОН)2(к); ∆H < 0. Напишите выражение для константы равновесия. В какую сторону сместится равновесие: а) при уменьшении давления; б) при увеличении температуры?
Решение:
Константа равновесия данной гетерогенной реакции, выраженная через равновесные концентрации, где [H2O] равновесная малярная концентрация воды, моль/л.
Согласно по принципу Ле-Шателье при внешнем воздействии на систему она стремится принять такое положение, при котором эффект был бы минимальным.
Прямая реакция протекает с изменением объема и выделением тепла (экзотермическая, так как ∆Н<0).
Исходя из этого:
1. Уменьшения давления в системе приведет к увеличению скорости обратной реакции и смещением равновесия влево.
2. Увеличение t в системе приведет к увеличению скорости обратной реакции и смещению равновесия влево, то есть реакция является эндотермической и протекает с поглощением теплоты.
K = 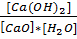
30. Напишите электронную формулу невозбужденного атома 15Р. Приведите графическую схему распределения электронов для двух внешних энергетических уровней и определите валентные возможности элемента.
Решение:
+15 Р 1s22s22p63s23p3

Р принадлежит к семейству р-элетронов.
При возбуждении один 3s-элетрон переходит на свободную d-орбиталь, валентность у фосфора V .
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|