
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
пятница. Акласс. Бкласс. Акласс. Бкласс. Вкласс. Акласс. Бкласс. В класс. Д.з. п.13-14, упр.9, стр.126.
15.01.2021 пятница
8 класс
| Урок | Предмет | Ссылка на задание |
| Химия Папулов Н.И. | тема: "Генетическая связь между основными классами неорганических соединений" работаем по ссылке:
https://infourok.ru/videouroki/926
ЦЕЛЬ.На конкретных примерах доказать существование генетической связи между основными классами неорганических веществ. Задачи: Обучающие: систематизировать знания учащихся о составе и свойствах основных классов неорганических веществ. Устный ответ на вопросы: Какие вещества нас окружают в повседневной жизни? Какие простые вещества вам известны? Какие сложные вещества? Что такое оксид? Какие бывают оксиды? Приведите примеры. Что такое кислота? Что такое основание? Какие бывают основания? Что такое соль?
«Рабочая карта урока» Задания выполняем в тетради.
Задание № 1
«Найди лишнее вещество»
1) SO3, HNO3, FeO, K2O, CO2, CuO. 2) HNO3, H2SO4, Al(OH)3, HCl, H3PO4, H2CO3. 3) Zn(OH)2, KOH, Fe(OH)2, Ba, NaOH, Ba(OH)2. 4) KNO3, FeSO4, NaCl, Al2S3, BaO, CaCO3 Задание № 2
Распредели вещества по 4 колонкам (оксиды, основания, кислоты и соли)
Ca(OH)2, CI2, HCI, Ca, P, CaCO3, NaOH, CaO, CO2, AI(OH)3, AI2O3, HNO3, NaH, Na, NaNO3,CI2O7, HCIO4 , AICI3, NaCIO4, Zn(OH)2, KOH, Fe(OH)2, Ba(OH)2, FeSO4,K2O, CuO, H2CO3, H2SO4, FeO, H3PO4.
Задание № 3 Ответь на вопросы
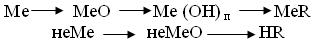 Формулировка вывода: ДОМАШНЕЕ ЗАДАНИЕ Повторить тему: «Основные классы неорганических соединений», составить уравнения реакций к цепочкам, которые вы составили при выполнении задания №4 (отправить в личку до 20.01)
Формулировка вывода: ДОМАШНЕЕ ЗАДАНИЕ Повторить тему: «Основные классы неорганических соединений», составить уравнения реакций к цепочкам, которые вы составили при выполнении задания №4 (отправить в личку до 20.01)
| |
| Игр.сп Чернов О.А. | ||
| Казантаева В.В.1 ИВМ Здорик АС.2 Инд.Пр | https://stepik.org/lesson/8242/step/1?unit=1418 Структура проекта | |
| Популов Н.И. 2 ИВХим Здорик АС.1 Инд.Пр | Закончить уравнения реакций, протекание которых возможно (!); уравнять; назвать реагенты и продукты реакции: 1. Al2O3+HCl→; 2. Fe + H2SO4 →; 3. CaCO3 →; 4.Fe(OH)2→; 5. CO2+H2О→; 6. C+H2→; 7. H2O→; 8. Al + H2SO4 →; 9. Na+O2→; 10. Mg+H2CO3→; 11. Al + O2 →; 12.Ca+ H2O→ Решить задачи: 1. Определите формулу гидроксида железа, если массовые доли составляющих его элементов: 62,2% Fe, 35,6% О и 2,2% Н. 2. Определить массу, число структурных частиц и объём 3 моль газа оксида азота (V) (н.у.). Структура проекта | |
| Казантаева В.В:1Математ. Нестерова А.Н:2 Математ. | Домашняя контрольная работа (отдельный файл)
Домашняя контрольная работа
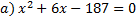 б) б) 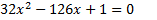
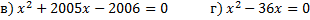 .
2. Разложите на множители квадратный трёхчлен
а) .
2. Разложите на множители квадратный трёхчлен
а) 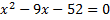 б) б) 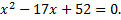 3. Уравнение
3. Уравнение 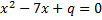 имеет корень -3. Найдите его второй корень и число q.
4. Пусть имеет корень -3. Найдите его второй корень и число q.
4. Пусть 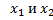 корни квадратного уравнения корни квадратного уравнения 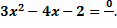 Составьте квадратное уравнение, корнями которого являются числа
Составьте квадратное уравнение, корнями которого являются числа 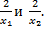 5. Несколько одноклассников организовали турнир по шашкам. Каждый участник турнира сыграл с каждым по одной партии. За выигрыш присуждали 2 очка, за ничью – 1 очко, за проигрыш – 0 очков. Пять самых слабых игроков набрали вместе 26 очков - в 5 раз меньше, чем остальные участники вместе взятые. Сколько было участников турнира?
П 4.1 номера 198, 199, 200, 201(а,в), 202 (1 и 2 стб) Дома 201(б,г), 202 (3стб)
--
5. Несколько одноклассников организовали турнир по шашкам. Каждый участник турнира сыграл с каждым по одной партии. За выигрыш присуждали 2 очка, за ничью – 1 очко, за проигрыш – 0 очков. Пять самых слабых игроков набрали вместе 26 очков - в 5 раз меньше, чем остальные участники вместе взятые. Сколько было участников турнира?
П 4.1 номера 198, 199, 200, 201(а,в), 202 (1 и 2 стб) Дома 201(б,г), 202 (3стб)
--
| |
| Головина Т.В 1. Фр.яз Головина Т.В 2. Фр.яз | французский язык учебник с 40-41 (числительные от 11 до 30), текст на с 40 читать, переводить, с 43 I, II читать | |
9Акласс
| Урок | Предмет | Ссылка на задание |
| Матем Казантаева В.В. | п.7,1 https://www.yaklass.ru/TestWork/Join/vk7f_VoVB0Op0D1TfKrLWg Повторение: https://stepik.org/lesson/8258/step/1?unit=1433, https://stepik.org/lesson/10283/step/1?unit=1978 | |
| Химия Папулов Н.И. | ема: Соединения галогенов работаем по ссылке https://infourok.ru/videouroki/947
Образовательные: сформировать представление о физических и химических свойствах галогеноводородов и галогенидов металлов, о качественных реакциях на галогениды, способах лабораторного и промышленного получения хлороводорода, сравнительной силы кислот; обогатить личный опыт учащихся самостоятельным проведением учебного эксперимента.
Ход урока.
1. Орг. момент
2. Актуализация ранее изученного материала.
На прошлых уроках мы с вами начали знакомство с галогенами. Вспомним, что мы знаем по данной группе химических элементов.
Устный опрос.
1. Какие элементы называются галогенами?
2. Охарактеризуйте положение галогенов в Периодической системе Д.И.Менделеева.
3. Какие свойства и почему проявляют галогены с точки зрения ОВР?
3. Изучение нового материала.
Эпиграфы:
Истина не рождается в голове
она рождается между людьми, совместно ищущими,
в процессе их диалогического общения.
М.М. Бахтин
Опыт и наблюдение - таковы величайшие источники мудрости,
доступ к которым открыт для каждого человека.
(Чаннинг.)
1. Инструктивная карточка «Галогеноводороды и галогеноводородные кислоты»
Прочитайте внимательно §12 (с. 110-111) и ответьте на вопросы:
| |
| Биология Бузмакова О.Л. | биология по 2 урока - Просмотр фильмов перед изучением темы по ссылкам https://infourok.ru/videouroki/276 https://infourok.ru/videouroki/277 Тема урока: Индивидуальное развитие организмов. Влияние факторов среды на организм. Работа с презентацией и § 13 и 14 - написание конспекта. Д/З Конспекты УЧИТЬ, повторить митоз и мейоз, подготовиться к проверочной работе.. | |
| Биология Бузмакова О.Л. | ||
| ИВБио Бузмакова О.Л. | ИВБио - Тема занятия: Внимательно проработать презентацию и лекцию по теме " Класс Ракообразные", записать конспект в отдельную тетрадь - Для подготовки к Олимпиадам, ЕГЭ и ВПР. | |
| ИВХим Папулов Н.И. | ИВХ-9 класс- работаем по ссылке на сайте решу ОГЭ https://chem-oge.sdamgia.ru/test?id=1801967&print=true | |
| Англ.яз Иванова С.И. Нем. яз. Хмелева Р.А. | На уроках: SB: с 76-77 упр 1-6 + видео (VIDEOUROKI.) + АУДИО https://resh.edu.ru/subject/lesson/2806/start/ Домашнее задание: учебник: с 76-77 (новые слова), диалог упр 4b с 77 выучить Тема: Урок контроля. Задание: 1) учебник стр. 71-72 упр.1-7 (устно); 2) учебник стр. 72 упр. 9 текст читать, переводить ( обратная связь- отправить чтение текста голосовым сообщением, письменный перевод текста). |
9Бкласс
| Урок | Предмет | Ссылка на задание |
| Биология Бузмакова О.Л. | биология по 2 урока - Просмотр фильмов перед изучением темы по ссылкам https://infourok.ru/videouroki/276 https://infourok.ru/videouroki/277 Тема урока: Индивидуальное развитие организмов. Влияние факторов среды на организм. Работа с презентацией и § 13 и 14 - написание конспекта. Д/З Конспекты УЧИТЬ, повторить митоз и мейоз, подготовиться к проверочной работе.. | |
| Биология Бузмакова О.Л. | ||
| Химия Папулов Н.И. | ема: Соединения галогенов работаем по ссылке https://infourok.ru/videouroki/947
Образовательные: сформировать представление о физических и химических свойствах галогеноводородов и галогенидов металлов, о качественных реакциях на галогениды, способах лабораторного и промышленного получения хлороводорода, сравнительной силы кислот; обогатить личный опыт учащихся самостоятельным проведением учебного эксперимента.
Ход урока.
1. Орг. момент
2. Актуализация ранее изученного материала.
На прошлых уроках мы с вами начали знакомство с галогенами. Вспомним, что мы знаем по данной группе химических элементов.
Устный опрос.
1. Какие элементы называются галогенами?
2. Охарактеризуйте положение галогенов в Периодической системе Д.И.Менделеева.
3. Какие свойства и почему проявляют галогены с точки зрения ОВР?
3. Изучение нового материала.
Эпиграфы:
Истина не рождается в голове
она рождается между людьми, совместно ищущими,
в процессе их диалогического общения.
М.М. Бахтин
Опыт и наблюдение - таковы величайшие источники мудрости,
доступ к которым открыт для каждого человека.
(Чаннинг.)
1. Инструктивная карточка «Галогеноводороды и галогеноводородные кислоты»
Прочитайте внимательно §12 (с. 110-111) и ответьте на вопросы:
| |
| Матем Казантаева В.В. | https://www.yaklass.ru/TestWork/Join/m2dkqrnubEuYc-OXU3OUWw Повторение: https://stepik.org/lesson/8267/step/1?unit=1442 | |
| Англ.яз Головина Т.В. Нем. яз. Хмелева Р.А. | 9 класс: Видео урок «Types of music» https://videouroki.net/blog/vidieourok-types-of-music.html посмотреть видео, записать слова, написать о своих предпочтениях в музыке (используя лексику урока) Тема: Урок контроля. Задание: 1) учебник стр. 71-72 упр.1-7 (устно); 2) учебник стр. 72 упр. 9 текст читать, переводить ( обратная связь- отправить чтение текста голосовым сообщением, письменный перевод текста). | |
| Казантаева В.В:1 ИВМ Казантаева В.В:2 ИВМ | https://stepik.org/lesson/8249/step/1?unit=1424 | |
10Акласс
| Урок | Предмет | Ссылка на задание |
| Химия Мосталыгина Л.В. | Занятие 11. 1. Галогенпроизводные углеводородов 2. Обобщающее повторение по теме “Углеводороды” 3. Контрольная работа № 3по теме “Углеводороды” Домашнее задание:читать § 42 (упр. 3-8, 13,14,16), § 41 (записи в тетради), выполнить упражнение 10 ДЗ проверяю выборочно! | |
| Химия Мосталыгина Л.В. | ||
| Химия Мосталыгина Л.В. | ||
| БиоТех Мосталыгина Л.В. | Электив «ВВЕДЕНИЕ В ХИМИЧЕСКУЮ ТЕХНОЛОГИЮ И БИОТЕХНОЛОГИЮ» Тема. Производство металлов (6 часов) Производство чугуна. Химическая концепция (1 час.) 1. Написать все химические реакции, лежащие в основе производства чугуна | |
| ОБХ Мосталыгина Л.В. | Электив «ОСНОВЫ БИОХИМИИ – ХИМИИ ЖИЗНИ» Тема. Химическое равновесие и его смещение. Стационарное состояние Пользуясь информацией по ссылкам (СУНЦ МГУ школа им. А.Н.Колмогорова): Посмотреть видео: https://youtu.be/cz92RmcK9jU и презентацию: https://internat.msu.ru/media/uploads/2019/09/lektsiya-6-Himicheskoe-ravnovesie.pdf | |
| Инд.Пр Здорик А.С. | Работа над теоретической частью исследования | |
| Химия | Дополнительное занятие_10а (14 занятие 27, 28 час) 1. Тема «Основы химической термодинамики и химической кинетики» (2 часа) Посмотреть презентацию по ссылке (Химическая термодинамика и кинетика). https://internat.msu.ru/media/uploads/2019/09/lektsiya-5-Energetika-protsessov.pdf (Конспект) и видео по ссыке https://youtu.be/XUhdG06A5w4 По книге А.Н.Левкин, Н.Е.Кузнецова “Задачник по химии”. М.: Вентана-Граф, 2012. - 240с. С. 65, глава 4. Основы химической термодинамики. Читать теорию и выполнить упражнения 4-2; 4-9; 4-17; 4-20; 4-26; 4-35; 4-40 |
10Бкласс
| Урок | Предмет | Ссылка на задание |
| Трубина С.М.:1 Математ Литвинов А.Н.:2 Ос.Алг | Программирование. https://stepik.org/course/67/syllabus https://informatics.mccme.ru/mod/statements/view.php?id=11098#1 Задачи согласно индивидуальным вариантам | |
| Трубина С.М.:1 Математ Литвинов А.Н.:2 Ос.Алг | ||
| Головина Т.В.:1 Англ. Яз Нем.яз. Хмелева Р.А. Трубина С.М.:2 Математ | учебник с 86-87 упр 1-9 Тема: Шесть дней в Канаде. Выполнение тестовых заданий по прочитанному. Задание: 1) просмотреть видеофильм « Растения» , выписать все слова и выражения в тетрадь; 2) учебник стр. 58 упр.10 (а) записать новые слова в словарь и выучить; 3) учебник стр. 58 упр.10 текст А читать, выполнить письменно задания к тексту (обратная связь – выслать письменные задания после текста); 4) учебник стр. 59 текст В читать, выполнить письменно задания к тексту (обратная связь – выслать письменные задания после текста | |
| Трубина С.М.:2 Математ Литвинов А.Н.:1 Ос.Алг | ||
| Иванова С.И.:2 Англ. яз. Трубин А.В:1 Физика | На уроках: SB: стр 82-83 упр 2-7 + презентация https://resh.edu.ru/subject/lesson/6343/start/160682/ Домашнее задание: выучить новые слова с 82-83 Контрольная работа Молекулярная физика и термодинамика Электронные тетради 55, 56, 57 Видеоучебник 37, 38, 39, 40 Тесты 37, 38, 39, 40 | |
| Иванова С.И.:2 Англ. яз. Трубин А.В:1 Физика | ||
10Вкласс
| Урок | Предмет | Ссылка на задание |
| Иванова С.И.:2 Англ. яз. МерзляковаН.М.:1 Рус.яз. | https://join.skype.com/p5t7d5tkgBIo На уроках: WB: с. 32-33 упр 1-4 (контроль), SB: с.70-71 упр 1-6 + video Домашнее задание: знать лексику урока, правило с 173, упр 16, с.71 упр 8 | |
| Иванова С.И.:2 Англ. яз. МерзляковаН.М.1 ИВРусЯз. | ||
| Игр.сп Чернов О.А | ||
| Головина Т.В.:1 Англ. яз Коленникова Н.А:2 ТГиПЗС | учебник с 86-87 упр 1-9 Домашнее задание: 1. Изучить материал из книги « История государства и права зарубежных стран. Часть 1. Учебник для вузов». Под ред. проф. Крашенинниковой Н.А и проф. Жидкова О. А ( стр. 94-107) 2. Составить конспект по данному материалу. | |
| Химия Папулов Н.И. | Тема урока: Спирты . Работаем по ссылкеhttps://infourok.ru/videouroki/818
Цели урока:
Обучающие: Ознакомить учащихся с классификацией спиртов, их номенклатурой и изомерией. Сформировать у учащихся представления о строении, физических свойствах спиртов. Рассмотреть влияние строения спиртов на их свойства. Ознакомить с представителями спиртов, их влиянием на организм человека, нахождением в природе.
Ход урока
I. Изучение нового материала
Мы начинаем изучение нового класса органических соединений, в состав которых, помимо углерода и водорода, входит кислород. Они называются кислородосодержащими. Простейшими кислородосодержащими органическими веществами являются спирты. Молекулы спиртов содержат гидроксильную группу, которая является функциональной группой для этого класса. Что мы называем функциональной группой?
Группа атомов (или атом) определяющих принадлежность соединения к определенному классу и обусловливающая его важнейшие химические свойства называется ФГ.
1. Классификация, номенклатура и изомерия спиртов.
Посмотрим, какую же молекулярную формулу имеет один из представителей спиртов – этиловый спирт. Это формула - С2Н6О
Зная валентность атомов, на доске изобразим его строение.
СН3 – СН2 – ОН или СН3 – О – СН3
Проведём расчёты, зная, что из 0,1 моль спирта при взаимодействии с металлическим натрием удается получить (при н.у.) 1,12 л водорода. Это означает, что из 1 моль спирта натрий вытесняет 11,2л или 0,5 моль водорода. Из каждой молекулы спирта натрием вытесняется только один атом водорода.
Объяснение такому факту дает только формула СН3 – СН2 – ОН. Один атом водорода находится в особом положении: соединен с атомом углерода через кислород. Он и вытесняется натрием. Вторая формула не дает объяснения такому факту (эта формула принадлежит диметиловому эфиру, позже мы будем изучать и этот класс веществ). Согласно этой формуле, все атомы водорода равноценны.
Формулируется определение спиртов.
Спирты – производные углеводородов, содержащих одну или несколько гидроксильных групп. (Определение учащиеся записывают в рабочую тетрадь).
А) Рассмотрим типы классификации спиртов.
1) По числу гидроксильных групп (ОН) спирты бывают одноатомные и многоатомные (двухатомные, трехатомные).
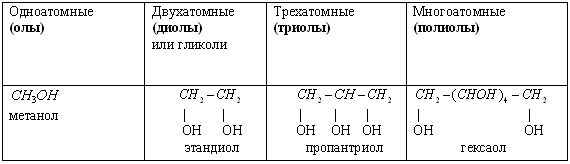 2) По характеру углеводородного радикала спирты бывают предельные, непредельные, ароматические.
2) По характеру углеводородного радикала спирты бывают предельные, непредельные, ароматические.
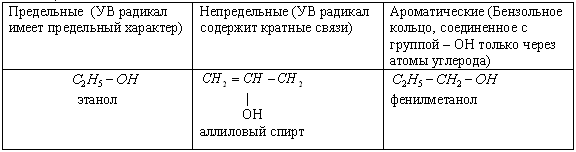 3) По характеру атома углерода, с которым связана гидроксильная группа, спирты бываю первичные, вторичные, третичные.
3) По характеру атома углерода, с которым связана гидроксильная группа, спирты бываю первичные, вторичные, третичные.
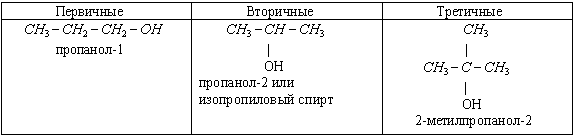 Учитель обращает внимание на то, что четвертичных спиртов не существует, т.к. четвертичный атом С связан с 4 другими атомами С, поэтому на связь с гидроксильной группой нет больше валентностей.
Учитель обращает внимание на то, что четвертичных спиртов не существует, т.к. четвертичный атом С связан с 4 другими атомами С, поэтому на связь с гидроксильной группой нет больше валентностей.
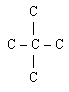 Б) Изомерия спиртов. Для предельных одноатомных спиртов характерны следующие виды изомерии:
- углеродного скелета
Б) Изомерия спиртов. Для предельных одноатомных спиртов характерны следующие виды изомерии:
- углеродного скелета
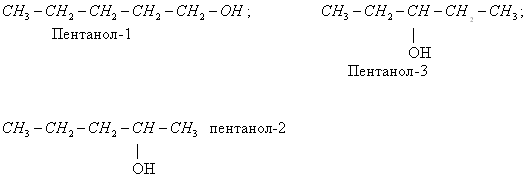
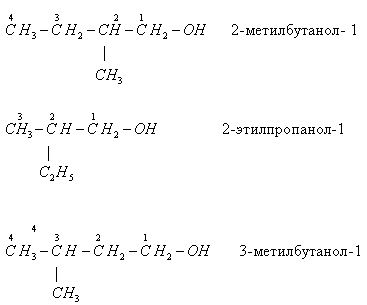 - положения функциональной группы
- положения функциональной группы
 - межклассовая изомерия
(СН3 – СН2 – ОН этиловый спирт и СН3 – О – СН3 диметиловый эфир)
В) Номенклатура спиртов.
К названию углеводорода добавляют количество гидроксогрупп (префикс), затем – суффикс ОЛ, затем указываются номера атомов углерода, с которыми соединены функциональные группы. Например:
- межклассовая изомерия
(СН3 – СН2 – ОН этиловый спирт и СН3 – О – СН3 диметиловый эфир)
В) Номенклатура спиртов.
К названию углеводорода добавляют количество гидроксогрупп (префикс), затем – суффикс ОЛ, затем указываются номера атомов углерода, с которыми соединены функциональные группы. Например:
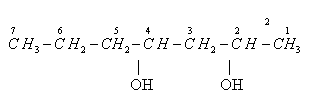 Порядок построения названия:
1. Углеродная цепь нумеруется с конца к которому ближе находится группа –ОН. 2. Основная цепь содержит 7 атомов С, значит соответствующий УВ гептан. 3. Число групп – ОН равно 2, префикс – «ди». 4. Гидроксильные группы находятся при 2 и 3 атомах углерода, n = 2 и 4.
Название данного спирта - гептандиол-2,4
Выполнить задание №1 на закрепление первой части нового материала: дана формула спиртаСН3 – СН2 – СН2 – СН2 – СН2 – ОН
классифицировать данный спирт по всем типам классификации. Написать изомеры и назвать по международной номеклатуре.
Общая формула спиртов (одноатомных предельных) СnH2n+1OH или R – OH, где R- углеводородный радикал.
2. Физические свойства спиртов
Предельные одноатомные спирты, имеющие до 11 атомов углерода, являются жидкостями, спирты с числом атомов углерода 12 и более являются твердыми веществами. Это можно объяснить наличием в молекулах спиртов водородных связей. Водородные связи способствуют хорошей растворимости веществ, повышению температуры плавления и кипения веществ, вследствие объединения нескольких молекул. Т.е. она оказывает большое влияние на физические свойства соединений.
3. Химические свойства и получение спиртов. Параграф учебника 9 Спирты. Работаем по сылке https://infourok.ru/videouroki/819
Д.з. 1. Осуществить схему превращения: этилен----- этанол ------ этаналь
2.При взаимодействии 3г. предельного одноатомного спирта с необходимым количеством натрия выделилось 0,56 л (н.у.) водорода. Выведите формулу спирта, запишите формулу возможных изомеров и дайте их названия. (отправить в личку до 22.01.21)
Порядок построения названия:
1. Углеродная цепь нумеруется с конца к которому ближе находится группа –ОН. 2. Основная цепь содержит 7 атомов С, значит соответствующий УВ гептан. 3. Число групп – ОН равно 2, префикс – «ди». 4. Гидроксильные группы находятся при 2 и 3 атомах углерода, n = 2 и 4.
Название данного спирта - гептандиол-2,4
Выполнить задание №1 на закрепление первой части нового материала: дана формула спиртаСН3 – СН2 – СН2 – СН2 – СН2 – ОН
классифицировать данный спирт по всем типам классификации. Написать изомеры и назвать по международной номеклатуре.
Общая формула спиртов (одноатомных предельных) СnH2n+1OH или R – OH, где R- углеводородный радикал.
2. Физические свойства спиртов
Предельные одноатомные спирты, имеющие до 11 атомов углерода, являются жидкостями, спирты с числом атомов углерода 12 и более являются твердыми веществами. Это можно объяснить наличием в молекулах спиртов водородных связей. Водородные связи способствуют хорошей растворимости веществ, повышению температуры плавления и кипения веществ, вследствие объединения нескольких молекул. Т.е. она оказывает большое влияние на физические свойства соединений.
3. Химические свойства и получение спиртов. Параграф учебника 9 Спирты. Работаем по сылке https://infourok.ru/videouroki/819
Д.з. 1. Осуществить схему превращения: этилен----- этанол ------ этаналь
2.При взаимодействии 3г. предельного одноатомного спирта с необходимым количеством натрия выделилось 0,56 л (н.у.) водорода. Выведите формулу спирта, запишите формулу возможных изомеров и дайте их названия. (отправить в личку до 22.01.21)
| |
| Биология Бузмакова О.Л | Перед изучением темы просмотр фильма по ссылке https://infourok.ru/videouroki/6 Тема урока: Вирусы - неклеточная форма жизни. Изучить §18 учебника, составить конспект. Д/З Конспект учить. | |
| РодРЯ Мерзлякова Н.М | 1) Повторить записи в рабочей тетради по теме «Этикет делового общения». 2) Выполните задания: а) Прочитайте фрагменты словарных статей. Попугай, -я, м. 2. перен. Разг. Тот, кто не имеет собственного мнения и повторяет чужие мысли, слова. Ворона, -ы, ж. 2. перен. Разг. О рассеянном, невнимательном человеке. Орёл, орла, м. 2. перен. О гордом, смелом, сильном человеке. Сорока, -и, ж. 2. перен. Разг. О болтливом, шумном человеке; о том, кто любит сплетничать (преимущественно о женщине). Всё болтаете, сороки! б) Найдите в Национальном корпусе русского языка предложения, в которых слова употребляются в этих значениях. Не забывайте указывать авторов произведений, их названия. в) Наименования каких ещё животных и птиц могут быть использованы в русском языке для характеристики человека? | |
11Акласс
| Урок | Предмет | Ссылка на задание |
| Физ-ра Чернов О.А. | ОФП. Комплекс упражнений на верхний плечевой пояс и опорно-двигательный аппарат. Специально-беговые упражнения. Комплекс упражнений на развитие силовой выносливости (использовать отягощения, отжимания, подтягивание). Изучить классические лыжные ходы и переход с одного хода на другой. 10В.Игровые виды спорта. Изучение стратегии шахмат и шашек. Дебют,атакующая игра. Способы защиты. | |
| Общ(ЭП) Коленникова Н.А | Тема: Политическое сознание. Средства массовой информации и политическое сознание. Политическая элита, особенности её формирования в современной России. Вопросы для изучения: 1. Что такое политическое сознание. 2. Средства массовой информации и политическое сознание. 3. Политическая элита, особенности её формирования в современной России. Домашнее задание: 1. Изучить материал пар. 15. (составить конспект) 2. Изучить интернет – ресурсы. https://resh.edu.ru/subject/lesson/5577/main/227149/ https://resh.edu.ru/subject/lesson/6141/main/289734/ https://resh.edu.ru/subject/lesson/4196/main/227547/ | |
| Общ(ЭП) Коленникова Н.А | ||
| Инфор Водяной А.А.:1 | ||
| Рус.яз Мерзлякова Н.М. | 1) Учебник: изучить §§ 92, 93; повторить § 91; 2) повторить записи в рабочей тетради по теме «Знаки препинания при вставных конструкциях, словах-предложениях, междометиях»; 3) задания на ЯКласс по теме «Знаки препинания при словах и конструкциях, грамматически не связанных с предложением» (инд. ссылка); 4) решать онлайн задание №18 ЕГЭ. | |
| РЯОСП Мерзлякова Н.М. | ||
11Бкласс
| Урок | Предмет | Ссылка на задание |
| Бабушкина О.В.:1 Матем Трубин А.В.:2 Физика | тренировочный вариант 152, 17 №13 Постулаты специальной теории относительности Эйнштейна. Пространство и время в специальной теории относительности Электронные тетради 34, 35 Видеоучебник 36, 37, 38 Тесты 36, 37, 38 | |
| Бабушкина О.В.:1 Матем Трубин А.В.:2 Физика | ||
| Бабушкина О.В.:2 Матем Трубин А.В.:1 Физика | Уравнение Эйнштейна для фотоэффекта Давление света Электронные тетради 39, 40 Видеоучебник 42, 43, 44 Тесты 42, 43, 44 | |
| Бабушкина О.В.:2 Матем Трубин А.В.:1 Физика | тренировочный вариант 152, 17 №13 | |
| Общ(ЭП)Коленникова Н.А. | Тема: Политическое сознание. Средства массовой информации и политическое сознание. Политическая элита, особенности её формирования в современной России. Вопросы для изучения: 1. Что такое политическое сознание. 2. Средства массовой информации и политическое сознание. 3. Политическая элита, особенности её формирования в современной России. Домашнее задание: 1. Изучить материал пар. 15. (составить конспект) 2. Изучить интернет – ресурсы. https://resh.edu.ru/subject/lesson/5577/main/227149/ https://resh.edu.ru/subject/lesson/6141/main/289734/ https://resh.edu.ru/subject/lesson/4196/main/227547/ | |
| Общ(ЭП)Коленникова Н.А. | ||
| МРФЗ Трубин А.В.:2 |
11В класс
| Урок | Предмет | Ссылка на задание | ||||||||||||||||||||||||||||||||
| Англ.яз Головина Т.В.:1 | 1 урок: РЭШ урок 27 Homes and neighbourhoods https://resh.edu.ru/subject/lesson/3641/main/107919/ | |||||||||||||||||||||||||||||||||
| Англ.яз Головина Т.В.:1 | 2 урок: РЭШ урок 28 Problems in an neighbourhood https://resh.edu.ru/subject/lesson/3707/start/57556/ | |||||||||||||||||||||||||||||||||
| Иванова С.И.:2 Англ. яз. МерзляковаН.М.1 РусЯз. | https://join.skype.com/dXtYLcVauZDf На уроках: WB: с. 32-33 упр 1-5 (контроль), SB: с.78-79 упр 1-6 Домашнее задание: WB: с. 36-37 № 1 - 5 1) Учебник: изучить §§ 92, 93; повторить § 91; 2) повторить записи в рабочей тетради по теме «Знаки препинания при вставных конструкциях, словах-предложениях, междометиях»; 3) задания на ЯКласс по теме «Знаки препинания при словах и конструкциях, грамматически не связанных с предложением» (инд. ссылка); 4) решать онлайн задание №18 ЕГЭ. | |||||||||||||||||||||||||||||||||
| Иванова С.И.:2 Англ. яз. МерзляковаН.М.1 РЯОСП | ||||||||||||||||||||||||||||||||||
| Водяной А.А.:2 Инфор Бабушкина О.В.:1 Матем | тренировочный вариант 152, 17 №13 | |||||||||||||||||||||||||||||||||
| Матем Бабушкина О.В.:1 | ||||||||||||||||||||||||||||||||||
| Химия Папулов Н.И. | Классификация химических реакций
Урок химии в 11 классе.
Цели и задачи:
Образовательные: систематизировать и обобщить знания о типах химических реакций на основе атомно-молекулярного учения, теории электролитической диссоциации (ТЭД) и электронных представлений об окислительно-восстановительных процессах.
Ход урока: работа с учебником п. 13,14, по ссылке https://infourok.ru/videouroki/858
11В класс -ТЕМА: КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ.
1.Систематизируйте и обобщите свои знания о типах химических реакций,
заполнив таблицу 1 (отправить в личку до 20.01.21)
Таблица 1.
|
Д.з. п.13-14, упр.9, стр.126.