
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Лекция 56. Модель атома Резерфорда- Бора
Лекция 56
Модель атома Резерфорда- Бора
1. Экспериментальные факты.
А) атомы в целом электрически нейтральны;
Б) частица с наименьшим электрическим зарядом (электрон) находится внутри атома;
В) масса атома в 1000 раз больше массы электрона.
2. Модель Томсона- «пудинг с изюмом»
По мнению Томсона, весь атом заполнен положительным зарядом, а в него как изюминки вкраплены электроны. Резерфорд экспериментально решил проверить правильность модели Томсона
Установка Резерфорда состояла из тонкой золотой фольги, которую облучали альфа –частицами, вылетающими из радия, помещенного в свинцовый корпус. Пролетевшие сквозь фольгу альфа- частицы, попадали на экран, покрытый синеродистым барием. При попадании частицы экран светился.
Было установлено, что большая часть альфа частиц, пролетая сквозь фольгу либо не испытывала отклонений , либо отклонялись на малые углы. Лишь одна на 2000 частиц отлетала на углы около 180 градусов.

3. Планетарная модель атома Резерфорда.
В центре атома находится компактное массивное ядро, вокруг которого на большом расстоянии движутся электроны. Размер атома -10-8 см, размер ядра-10-13 см
Недостатки модели Резерфорда.
Электрон , двигаясь по окружности имеет центростремительное ускорение, следовательно должен излучать электромагнитные волны. Т.о. электрон должен терять энергию и падать на атом.
4. Постулаты Бора.
А) атомная система может находиться в особых стационарных состояниях, каждому из которых соответствует свое значение энергии Еn. В стационарном состоянии атомная система не излучает.
Б) При переходе системы из одного стационарного состояния в другое поглощается или излучается энергия. hν=En - Ek.
Энергия электрона отрицательная. Чем ближе к ядру, тем больше числовое значение энергии. На бесконечности энергия электрона равна нулю.
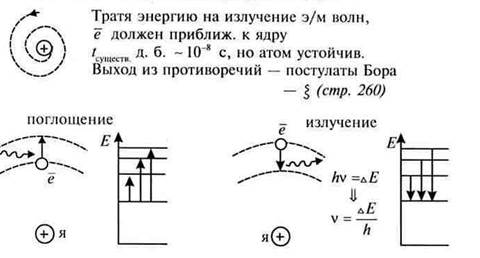
5. Недостатки теории Бора.
Эта теория смогла объяснить только закономерности построения атома водорода. По современным представлениям положение электрона подчиняется теории вероятности. Стационарные орбиты – это наиболее вероятные положения электронов в атоме.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|