
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Холодильный коэффициент, определяется как отношение отнятой от охлаждаемого тела теплоты Q2/A’=Q2/(Q’1-Q2)
Термодинамика - отдел теоретической физики, изучающий явления исключительно с точки зрения превращения энергии из одного вида в другой, не рассматривая их по существу.
Билет 1.
Макросистемой называется система, состоящая из очень большого числа частиц.
Термодинамический - Не рассматривая микроскопическое поведение отдельных частиц, термодинамика позволяет сделать ряд выводов относительно протекания процессов в макросистеме, оперируя некими интегральными понятиями - параметрами (давление, температура, объем) и функциями состояния (внутренняя энергия и энтропия).
Термодинамический метод основан на анализе условий и количественных соотношений, имеющих место в системе при различных превращениях энергии. Соотношения между разными видами энергии позволяют изучать физические свойства исследуемых систем при самых разнообразных процессах, в которых они участвуют и предсказать направления изменения состояния макросистем.
Статистический - Статистической физикой называется раздел физики, посвященный изучению свойств макросистем, исходя из свойств частиц, образующих эти системы, и взаимодействий между ними. Статистическая физика изучает закономерности, присущие всей совокупности частиц с помощью вероятностных методов. Она истолковывает физические свойства макросистем, непосредственно наблюдаемые на опыте и проявляющиеся как суммарный, усредненный результат действия отдельных частиц. Статистическая физика базируется на основных положениях молекулярно кинетической теории и изучает те свойства тел, которые наблюдаются на опыте (давление, температура и т.д.).
Параметры и функции состояния
Термодинамической системой (ТС) называется совокупность макроскопических тел, рассматриваемых методами термодинамики, т.е. с точки зрения обмена энергией между собой и внешней средой.
Термодинамическая система может находиться в различных состояниях, отличающихся температурой, давлением, объемом, плотностью и т.д. Подобные величины, характеризующие состояние системы, называются параметрами состояния - физические величины, характеризующие состояние термодинамической системы в условиях термодинамического равновесия.
Функция состояния в термодинамике — функция независимых параметров, определяющих равновесное состояние термодинамической системы; не зависит от пути (характера процесса), следуя которому система пришла в рассматриваемое равновесное состояние (т.е. не зависит от предыстории системы); к функциям состояния относят, в частности, характеристические функции системы:
- внутренняя энергия;
- энтропия;
- энтальпия и др.
Термодинамическая работа и количество теплоты не являются функциями состояния, так как их значение определяется видом процесса, в результате которого система изменила своё состояние.
Микросостояние — это состояние системы, определяемое одновременным заданием координат и импульсов всех составляющих систему частиц. Знание микросостояния в некоторый момент времени позволяет однозначно предсказать эволюцию системы во все последующие моменты.
Макросостояние — это состояние системы, характеризуемое небольшим числом макроскопических параметров. Одно макросостояние может быть реализовано большим числом микросостояний за счет перестановки частиц, не меняющей наблюдаемого состояния.
Термодинамическая вероятность W — число способов, которыми может быть реализовано состояние физической системы, или число микросостояний, осуществляющих данное макросостояние . Вероятность термодинамическая не является вероятностью в математическом смысле. Она применяется в статистической физике для определения свойств систем, находящихся в термодинамическом равновесии.
Энтропия в статистической физике
Согласно Больцману (1872), энтропия системы и термодинамическая вероятность связаны между собой следующим образом: 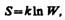
где k — постоянная Больцмана. Таким образом, энтропия определяется логарифмом числа микросостояний, с помощью которых может быть реализовано данное макросостояние. Следовательно, энтропия может рассматриваться как мера вероятности состояния термодинамической системы. Формула Больцмана позволяет дать энтропии следующее статистическое толкование: энтропия является мерой неупорядоченности системы. В самом деле, чем больше число микросостояний, реализующих данное макросостояние, тем больше энтропия. В состоянии равновесия — наиболее вероятного состояния системы — число микросостояний максимально, при этом максимальна и энтропия.
Билет 2,3,4,5,6.
1ое начало термодинамики
Представляет собой закон сохранения энергии для систем, в которых существенное значение имеют тепловые процессы. Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе.
Уравнение состояния идеального газа(уравнение Клапейрона — Менделеева)
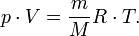
формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа
Работа и внутренняя энергия.
Таким образом, одним из процессов, приводящих к изменению внутренней энергии, является преобразование механической энергии во внутреннюю или наоборот. Работа является мерой изменения внутренней энергии при превращении механической энергии во внутреннюю или внутренней энергии в механическую.
точки зрения молекулярно-кинетической теории внутренняя энергия вещества складывается из кинетической энергии всех атомов и молекул и потенциальной энергии их взаимодействия друг с другом. В частности, внутренняя энергия идеального газа равна сумме кинетических энергий всех частиц газа, находящихся в непрерывном и беспорядочном тепловом движении.
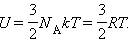
А1 = р∆V – работа газа.
А1 = -А = р∆V – работа внешних сил.
Теплоемкость
Теплоёмкость тела (обычно обозначается латинской буквой C) — физическая величина, определяющая отношение бесконечно малого количества теплоты δQ, полученного телом, к соответствующему приращению его температуры δT:
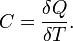
Изотермический процесс/Изобарный/Изохорный/Адиабатный (см. в тетради)
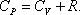 Это уравнение Майера для одного моля газа.
Это уравнение Майера для одного моля газа.
Адиабатический процесс для идеального газа описывается уравнением Пуассона.
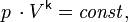
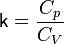 - показатель адиабаты.
- показатель адиабаты.
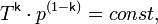
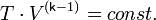
Билет 7.
Политропный процесс - термодинамический процесс, во время которого удельная теплоёмкость c газа остаётся неизменной.
Для идеального газа уравнение политропы может быть записано в виде:
pV^n = const
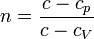 - показатель политропы
- показатель политропы
В зависимости от процесса можно определить значение n:
1. Изотермический процесс: n = 1, так как PV1 = const, значит PV = const, значит T = const.
2. Изобарный процесс: n = 0, так как PV0 = P = const.
3. Адиабатный процесс: n = γ, это следует из уравнения Пуассона.
Здесь γ — показатель адиабаты.
Величина n, зависящая от теплоемкости политропного процесса, называется показателем политропы. Будучи постоянным для конкретного процесса, значение показателя политропы может изменяться в зависимости от теплоемкости сп от +оо до —оо и определяет характер процесса.
Работа газа в политропическом процессе может быть определена с помощью интеграла при подстановке в него уравнения политропы 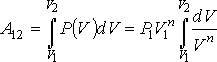
Интегрирование в выражении дает формулу для определения работы в политропическом процессе
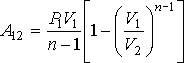
де: и p1 и v1 - начальные давление и объём газа, v2 - его конечный объём.
Из этой формулы, в частности, следует, что работа при расширении газа всегда остаётся положительной, независимо от того, какое значение принимает показатель политропы, больше или меньше единицы.
Теплоемкость является положительной величиной , если при получении тепла система разогревается и, наоборот, если система, отдавая тепло , охлаждается . Однако теплоемкость может быть и отрицательной . Это, как видно из формулы наблюдается в двух случаях:
1) при получении тепла система охлаждается ,
2) при отдаче тепла система разогревается .
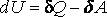
В первом случае газ производит работу расширения 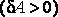 в количестве большем, чем количество теплоты
в количестве большем, чем количество теплоты 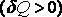 , которое подводится к газу в процессе расширения
, которое подводится к газу в процессе расширения 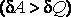 . В этом случае на производство работы помимо тепла, подведенного к газу, расходуется и некоторое количество его внутренней энергии. Хотя к газу и подводится тепло, но оно целиком превращается в работу, а убыль внутренней энергии
. В этом случае на производство работы помимо тепла, подведенного к газу, расходуется и некоторое количество его внутренней энергии. Хотя к газу и подводится тепло, но оно целиком превращается в работу, а убыль внутренней энергии 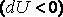 газа ведет к снижению температуры.
газа ведет к снижению температуры.
Во втором случае работа, производимая над газом при его сжатии 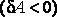 , оказывается по абсолютной величине большей, чем количество отдаваемого им тепла . С учетом знаков количества теплоты
, оказывается по абсолютной величине большей, чем количество отдаваемого им тепла . С учетом знаков количества теплоты  и работы
и работы 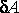 равенство принимает вид:
равенство принимает вид:
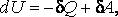
Внутренняя энергия системы увеличивается , а значит, ее температура растет, несмотря на то, что газ отдает теплоту. Подобный процесс происходит в некоторых звездах: гравитационные силы при сжатии звезды совершают работу большую, чем излучаемое ей тепло, поэтому звезда разогревается, несмотря на то, что она излучает теплоту. Наконец, обратим внимание на размерность теплоемкости. В системе СИ ее размерностью, как видно из формулы, является 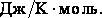
Билет 8.
Внутреннюю энергию тела нельзя измерить напрямую. Можно определить только изменение внутренней энергии:
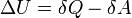
где
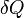 — подведённая к телу теплота, измеренная в джоулях
— подведённая к телу теплота, измеренная в джоулях
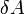 — работа, совершаемая телом против внешних сил, измеренная в джоулях
— работа, совершаемая телом против внешних сил, измеренная в джоулях
В теории идеального газа потенциальная энергия взаимодействия молекул считается равной нулю. Поэтому внутренняя энергия идеального газа определяется кинетической энергией движения всех его молекул. Средняя энергия движения одной молекулы равна
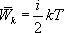
Так как в одном киломоле содержится 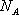 молекул, то внутренняя энергия одного киломоля газа будет
молекул, то внутренняя энергия одного киломоля газа будет
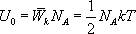
Учитывая, что 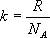 , получим
, получим 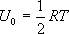
Для любой массы m газа, т.е. для любого числа киломолей 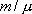 внутренняя энергия
внутренняя энергия
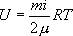
Из этого выражения следует, что внутренняя энергия является однозначной функцией состояния и, следовательно, при совершении системой любого процесса, в результате которого система возвращается в исходное состояние, полное изменение внутренней энергии равно нулю.
Равномерное распределение энергии по степеням свободы газовой молекулы:
В классической статистической физике выводится закон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная kT/2, а на каждую колебательную степень свободы — в среднем энергия, равная kT. Колебательная степень «обладает» вдвое большей энергией потому, что на нее приходится не только кинетическая энергия (как в случае поступательного и вращательного движений), но и потенциальная, причем средние значения кинетической и потенциальной энергий одинаковы. Таким образом, средняя энергия молекулы.
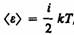
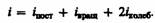
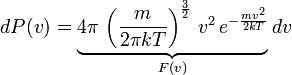
Так, мы получили 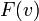 - функцию плотности вероятности, которая и называется распределением Максвелла.
- функцию плотности вероятности, которая и называется распределением Максвелла.
Условия применимости распределения Максвелла:
1. Равновесное состояние системы, состоящей из большого числа частиц.
2. Изотропная система.
3. Классическая система. Это значит, что система должна быть не релятивистской и не квантовой (взаимодействие частиц допускается, но только зависящее от относительного положения частиц).
Постоянная Больцмана - физическая постоянная, определяющая связь между температурой и энергией.
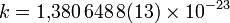 Дж/К
Дж/К
Универсальная газовая постоянная определяется как произведение постоянной Больцмана на число Авогадро, R = kNA. Газовая постоянная более удобна, когда число частиц задано в молях.
Молярные теплоемкости идеального газа
Молярная теплоемкость — теплоемкость 1 моля идеального газа.
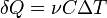
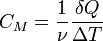
Билет 9.
Равнове́сный тепловой процесс — тепловой процесс, в котором система проходит непрерывный ряд бесконечно близких равновесных термодинамических состояний. Термодинамическое равновесие — состояние системы, при котором остаются неизменными по времени макроскопические величины этой системы (температура, давление, объем, энтропия) в условиях изолированности от окружающей среды.
Равновесный тепловой процесс называется обратимым, если его можно провести обратно и в телах, окружающих систему, не останется никаких изменений.
Реальные процессы изменения состояния системы всегда происходят с конечной скоростью, поэтому не могут быть равновесными. Реальный процесс изменения состояния системы будет тем ближе к равновесному, чем медленнее он совершается, поэтому равновесные процессы называют квазистатическими.
Квазистатический процесс в термодинамике — идеализированный процесс, состоящий из непрерывно следующих друг за другом состояний равновесия.
Неравновесные процессы, в термодинамике и статистической физике — физические процессы, включающие неравновесные состояния.
Неравновесное состояние, в термодинамике состояние системы, выведенной из равновесия термодинамического; в статистической физике — из состояния статистического равновесия. В системе, находящейся в Н. с., происходят необратимые процессы, которые стремятся вернуть систему в Состояние термодинамического (или статистического) равновесия, если нет препятствующих этому факторов.
Термодинами́ческие ци́клы — круговые процессы в термодинамике, то есть такие процессы, в которых начальные и конечные параметры, определяющие состояние рабочего тела (давление, объём, температура, энтропия), совпадают.
Термодинамические циклы являются моделями процессов, происходящих в реальных тепловых машинах для превращения тепла в механическую работу, а также для отъема тепла от более холодного тела и передачи его более горячему (охлаждения) под действием механической работы.
Теплова́я маши́на — устройство, преобразующее тепловую энергию в механическую работу (тепловой двигатель) или механическую работу в тепло (холодильник). Преобразование осуществляется за счёт изменения внутренней энергии рабочего тела — на практике обычно пара или газа.
Идеальная тепловая машина — машина, в которой произведённая работа и разница между количеством подведённого и отведённого тепла равны. Работа идеальной машины описывается циклом Карно.
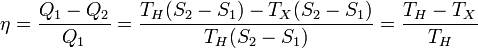
Заметим, что мощность тепловой машины Карно равна нулю, так как передача тепла в отсутствие разности температур идёт бесконечно медленно.
Цикл Карно - обеспечивает максимальную величину к.п.д., если заданы максимальная температура нагревателя и минимальная температура холодильника.
Холодильный коэффициент
Холодильный коэффициент, определяется как отношение отнятой от охлаждаемого тела теплоты Q2/A’=Q2/(Q’1-Q2)
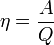
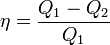
Холодильный коэффициент, безразмерная величина (обычно больше единицы), характеризующая энергетическую эффективность работы холодильной машины; равна отношению холодопроизводительности к количеству энергии (работе), затраченной в единицу времени на осуществление холодильного цикла.
eк = T0/(Т — Т0), где T0 и Т — абсолютные температуры охлаждаемого объекта и окружающей среды (кипения и конденсации хладагента). При заданной температуре окружающей среды Т на единицу полученного искусственного холода затрачивается тем большая энергия, чем ниже температура охлаждаемого объекта. Последняя характеризует термодинамическую ценность холода.
В течение цикла рабочее тело теплового двигателя получает от нагревателя количество теплоты Q1, совершает работу А и отдает некоторое количество теплоты Q2 < Q1 холодильнику. Все процессы совершаются квазистатически, что обеспечивает их обратимость.
Билет 10.
Отсюда коэффициент полезного действия тепловой машины Карно равен
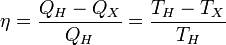
Цикл Карно состоит из четырёх стадий:
- Изотермическое расширение
- Адиабатическое расширение
- Изотермическое сжатие
- Адиабатическое сжатие
Рассмотрим теплообмен 2-х тел - изолированную систему: T1 > T2. Изменение энтропии равно.
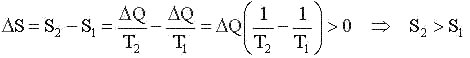
В изолированной системе возможны лишь процессы, ведущие к возрастанию энтропии.
Возрастание энтропии при теплообмене тел приводит к уменьшению доступности тепла для преобразования его в работу, т.е. обесцениванию тепловой энергии.
Из 1-го начала
dQ = dU + dA
с учётом dS = dQ ⁄ T получаем
dU = TdS − dA
Экологические проблемы использования тепловых машин. Мы живём в XXI веке, который невозможно представить без электростанций и автомобилей. Большая доля электростанций в мире – тепловые, то есть сжигающие топливо (уголь или газ). Автомобили, работающие на электричестве – редкость, все остальные сжигают топливо (бензин). При этом есть два губительных для окружающей среды обстоятельства.
Во-первых, выхлопные газы загрязняют атмосферу, делают её непригодной для нормальной жизнедеятельности человека. Во-вторых, выделяющееся тепло изменяет климат Земли и наносит непоправимый вред природе, животным и человеку. Поэтому задача человечества – переходить на более безопасные для окружающей среды двигатели.
Билет 11.
Обратимый процесс–если процесс может быть проведен в обратном направлении с теми же промежуточными путями.
Приведенная теплота.
Отношение теплоты Q в изотермическом процессе к температуре, при которой происходила передача теплоты, называется приведенной теплотой.
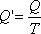
Для подсчета приведенной теплоты в произвольном процессе необходимо разбить этот процесс на бесконечно малые участки, где Т можно считать константой. Приведенная теплота на таком участке будет равна 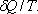 .
.
Направленность процесса
Теплота всегда самопроизвольно переходит только от более нагретых тел к менее нагретым, т. е. самопроизвольный или естественный процесс теплообмена обладает свойством определенной направленности — в сторону тел с более низкой температурой. При этом процесс теплообмена прекратится при достижении равенства температур.
для обратимого цикла Карно
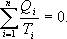
Так как любой замкнутый цикл можно представить как сумму бесконечного числа циклов Карно, то для любого замкнутого обратимого цикла выражение (9.26) будет справедливо и его можно записать в следующем виде
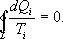
- Равенство Клаузиуса
Необратимый цикл Карно.В этом случае
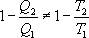
И все равенства превращаются в неравенства
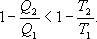
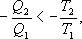
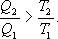
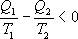
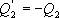
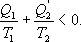
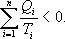
Неравенство Клаузиуса 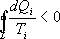
Таким образом, сумма приведенных теплот любого цикла равна нулю (обратимый процесс) или меньше нуля (необратимый процесс).
Энтропия
Функция состояния, полный дифференциал которой равен 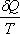 , называется энтропией (от греч. entropia – поворот, превращение) – мера способности теплоты превращаться в другие виды энергии.
, называется энтропией (от греч. entropia – поворот, превращение) – мера способности теплоты превращаться в другие виды энергии.
Энтропия S – это отношение полученной или отданной теплоты к температуре, при которой происходил этот процесс.
Для обратимых процессов изменение энтропии
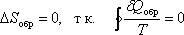
Это выражение называется равенство Клаузиуса.
Второе начало термодинамики
Второе начало термодинамики, принцип, устанавливающий необратимость макроскопических процессов, протекающих с конечной скоростью.
Другая формулировка второго начала термодинамики основывается на понятии энтропии:
«Энтропия изолированной системы не может уменьшаться» (закон неубывания энтропии).
Билет 12.
Полученные неравенства выражают собой закон возрастания энтропии, который можно сформулировать следующим образом:
В адиабатически изолированной термодинамической системе энтропия не может убывать: она или сохраняется, если в системе происходят только обратимые процессы, или возрастает, если в системе протекает хотя бы один необратимый процесс.
Таким образом, изолированная термодинамическая система стремится к максимальному значению энтропии, при котором наступает состояние термодинамического равновесия.
При изотермических процессах температура остаётся постоянной, при адиабатических отсутствует теплообмен, а значит, сохраняется энтропия:
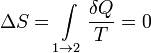
при δQ = 0.
Поэтому цикл Карно удобно представить в координатах T и S (температура и энтропия).
Билет 13.
Поскольку в системе при изохорном процессе происходит теплообмен с внешней средой, то происходит изменение энтропии.
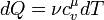
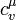 - молярная теплоемкостью при постоянном объеме.
- молярная теплоемкостью при постоянном объеме.
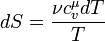
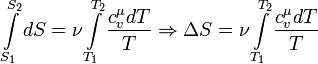
Изменение энтропии при квазистатическом изобарном процессе равно
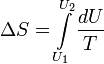
В случае, если изобарный процесс происходит в идеальном газе, то dU = d(νCvT + νRT) = ν(Cv + R)dT = νCpdT, следовательно, изменение энтропии можно выразить как 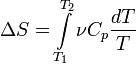
Если пренебречь зависимостью Cp от температуры, то 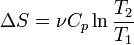
Изотермический процесс 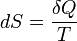
Термодинамическая вероятность— число способов, которыми может быть реализовано состояние физической системы.
Уравнение Больцмана связывает энтропию S идеального газа и термодинамическую вероятность — величину W, которая равна количеству микросостояний, соответствующих данному макросостоянию системы(статистический вес)
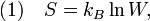
Иначе говоря, формула Больцмана показывает отношение между энтропией и числом способов конструирования данной системы из атомов или молекул.
Правило, позволяющее определить, в каком именно направлении будет идти процесс при заданных условиях, называется вторым началом термодинамики. Разные состояния тела, соответствующие различному расположению молекул (атомов, ионов) и разным значениям их скоростей, осуществляются с очень разной вероятностью.
По самому смыслу понятия вероятности любая система, предоставленная сама себе (то есть изолированная), будет переходить из состояния с меньшей вероятностью в состояние, вероятность которого больше. Обратный переход в принципе возможен, но практически невероятен.
Учитывая формулу Больцмана, мы сразу приходим к формулировке второго начала термодинамики: все реальные процессы в изолированной системе происходят в сторону состояний с большей вероятностью, то есть с увеличением энтропии. Таким образом, второе начало является вероятностным законом.
Билет 14.
Хаотическое движение молекул в газе приводит к тому, что в объеме газа поддерживается равновесное состояние, которое характеризуется постоянством параметров состояния газа и концентрации молекул во всем его объеме.
При нарушении равновесия в газе хаотическое движение молекул приводит к возникновению макроскопических потоков, стремящихся восстановить нарушенное равновесное состояние. Явления, возникающие при протекании этих процессов, называются явлениями переноса.
К явлениям переноса относят диффузию, внутреннее трение (вязкость), теплопроводность.
Диффузия - взаимное проникновение соприкасающихся веществ друг в друга вследствие теплового движения частиц вещества. Диффузия -этоявление, обусловленное переносом массы.
Процесс диффузии описывается законом Фика:
m = - D grad r S,
где m -масса газа, переносимая через площадь S в единицу времени; D -коэффициент диффузии; grad r = dr / dz -градиент плотности газа в направлении переноса.
Коэффицие́нт диффу́зии — количественная характеристика скорости диффузии.
(см.формулу в тетради).
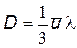 ;
;
Поток частиц и перенос массы.
(см. формулы в тетради)
Билет 15.
Общее уравнение перноса
Тогда общее уравнение переноса для любой величины через площадку единичной площади, перпендикулярную направлению переноса, будет следующим:
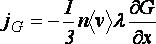
где
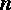 – концентрация молекул,
– концентрация молекул,
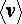 – средняя скорость молекул,
– средняя скорость молекул,
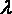 – расстояние свободного пробега.
– расстояние свободного пробега.
Коэффициент переноса – физ.величина, являющаяся характеристикой какого-либо явления переноса.
Поток качества
Качество – параметр, которым обладет частица (импульс, масса, энергия)
Потоки характеризуют скорость переноса физ. величины.
Билет 16.
Вязкость -внутреннее трение, свойство текучих тел (жидкостей и газов) оказывать сопротивление перемещению одной их части относительно другой.
Внутреннее трение - этоявление, обусловленное переносом импульса.
Сила трения, возникающая между слоями газа, определяется законом Ньютона:
Fтр = - h S grad v,
где h - коэффициент внутреннего трения (вязкости); v - скорость отдельных слоев газа; grad v -градиент скорости в направлении, перпендикулярном к поверхности, разделяющей слои (в нашем случае grad v = dvx / dz); S -площадь соприкасающихся слоев.
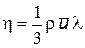 ; h = D r. – коэффициент вязкости
; h = D r. – коэффициент вязкости
Перенос импульса
(см. в учебнике)
Билет 17.
Теплопроводность, один из видов переноса теплоты (энергии теплового движения микрочастиц) от более нагретых частей тела к менее нагретым, приводящий к выравниванию температуры.
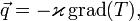
Поток энергии - плотность теплового потока — количество энергии, проходящей в единицу времени через единицу площади, перпендикулярной каждой оси
Билет 18.
Нестационарный процесс –плотность потока тепла постоянно меняется.
Нестационарный перенос тепла теплопроводностью описывается дифференциальным законом Фурье:
Cd∂T / ∂t ) = δ (λ δ T) + qv, где где C - удельная теплоемкость; d - плотность; qv - объемная плотность потока тепла от внутренних источников; t - время. При независящих от температуры свойствах C, d и l выражение может быть переписано так:
∂T / ∂t ) = a δ2T + (qv / Cd), где a = λ / Cd - коэффициент температуропроводности, характеризующий скорость распространения тепла в веществе.
Билет 19.
Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева.
Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объём. Состояние реального газа часто на практике описывается обобщённым уравнением Менделеева — Клапейрона:
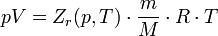
где p — давление; V - объем T — температура; Zr = Zr (p,T) — коэффициент сжимаемости газа; m - масса; М — молярная масса; R — газовая постоянная.
Термин «сжимаемость» также используется в термодинамике для описания отклонений термодинамических свойств реальных газов от свойств идеальных газов. Коэффициент сжимаемости определяется как
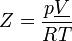
Ур-ие Ван-дер-Ваальса для 1 моля газа:
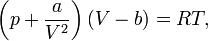
поправка a учитывает силы притяжения между молекулами (давление на стенку уменьшается, т.к. есть силы, втягивающие молекулы приграничного слоя внутрь), поправка b — силы отталкивания (из общего объёма вычитаем объём, занимаемый молекулами).
Для исследования поведения реального газа рассмотрим изотермы Ван-дер-Ваальса – кривые зависимости p от Vm при заданных Т, - определяемые уравнением Ван-дер-Ваальса для моля газа. Эти кривые, полученные для четырёх различных температур имеют довольно своеобразный характер: при высоких температурах (Т>Тк) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением её формы, оставаясь монотонно спадающей кривой; при некоторой температуре, на изотерме имеется лишь одна точка перегиба; при низких температурах (Т<Тк) изотермы имеют волнообразный участок, сначала монотонно опускаясь вниз, затем монотонно поднимаясь вверх и снова монотонно опускаясь.
Для пояснения характера изотерм реального газа преобразуем уравнение Ван-дер-Ваальса к виду: pV3m-(RT+pb)V2m+aVm-ab=0. Это уравнение при заданных р и Т Является уравнением третьей степени относительно Vm; следовательно, оно может иметь либо три вещественных корня, либо один вещественный и два мнимых, причём физический смысл имеют лишь вещественные положительные корни. Поэтому первому случаю соответствуют изотермы при низких температурах, второму случаю – изотермы при высоких температурах.
Критическая изотерма
При некоторой температуре Тк на изотерме имеется лишь одна точка перегиба К - Эта изотерма называется критической, соответствующая ей температу- температура Тк — критической температурой. Критическая изотерма имеет лишь одну точку перегиба К, называемую критической точкой; в этой точке касательная к ней параллельна оси абсцисс. Соответствующие этой точке объем Vк и давление Pк называются также критическими. Состояние с критическими параметрами (Pк Vк, Tк)называется критическим состоянием.
Сжижение газов включает в себя несколько стадий, необходимых для перевода газа в жидкое состояние.
Сжижение газов — сложный процесс, который включает в себя множество сжатий и расширений газа для достижения высокого давления и низких температур.
Абсолютный газ – который невозможно превратить в жидкость.
Внутренняя энергия реального газа складывается из кинетической энергии теплового движения его молекул и из потенциальной энергии межмолекулярного взаимодействия. Потенциальная энергия реального газа обусловлена только силами притяжения между молекулами.
Наличие сил притяжения приводит к возникновению внутреннего давления на газ
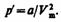
Работа, которая затрачивается для преодоления сил притяжения, действующих между молекулами газа, как известно из механики, идет на увеличение потенциальной энергии системы, т. е. 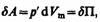 или
или 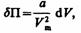 откуда
откуда 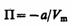
(постоянная интегрирования принята равной нулю). Знак минус означает, что молекулярные силы, создающие внутреннее давление р', являются силами притяжения. Учитывая оба слагаемых, получим, что внутренняя энергия моля реального газа
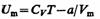
растет с повышением температуры и увеличением объема.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|