
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Важнейшие соединения кальция. Жёсткость и способы её устранения
Видеоурок относится к двум урокам https://www.youtube.com/watch?v=MrPjYo0v0k0
Важнейшие соединения кальция. Жёсткость и способы её устранения
ОКСИД КАЛЬЦИЯ
Получение
1) Окисление металлов 2Ca + O2 → 2CaO
2) Термическое разложение карбонатов
CaCO3 t˚C→ CaO + CO2
Химические свойства типичный ОСНОВНЫЙ оксид
Реагирует с водой ,кислотными оксидами и кислотами
СаO + H2O → Са(OH)2
3CaO + P2O5 → Ca3(PO4)2
Гидроксиды щелочноземельных металлов R(OH)2
Получение Реакции щелочноземельных металлов или их оксидов с водой:
CaO (негашеная известь) + H2O → Ca(OH)2(гашеная известь) Видео-опыт
Химические свойства
Гидроксиды R(OH)2 - белые кристаллические вещества, в воде растворимы хуже, чем гидроксиды щелочных металлов (растворимость гидроксидов уменьшается с уменьшением порядкового номера; Be(OH)2 – нерастворим в воде, растворяется в щелочах). Основность R(OH)2 увеличивается с увеличением атомного номера:
Са(OH)2 - щелочь
1) Реакции с кислотными оксидами:
Ca(OH)2 + СO2 → CaСO3↓ + H2O ! Качественная реакция на углекислый газ
2) Реакции с кислотами:
Сa(OH)2 + 2HNO3 → Сa(NO3)2 + 2H2O
3) Реакции обмена с солями:
3Сa(OH)2 + 2K3РO4 → Сa 3 (РO4) 2↓+6 KOH
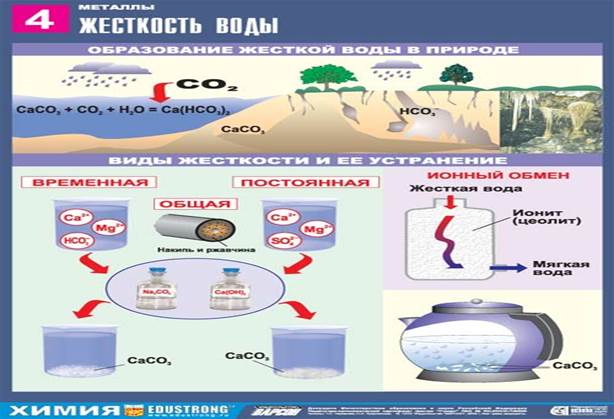 Природная вода, содержащая ионы Ca2+ и Mg2+, называется жесткой. Жесткая вода при кипячении образует накипь, в ней не развариваются пищевые продукты; моющие средства не дают пены.
Различают: Временную и Постоянную жесткость
Карбонатная (временная) жесткость обусловлена присутствием в воде гидрокарбонатов кальция и магния, некарбонатная (постоянная) жесткость – хлоридов и сульфатов.
Общая жесткость воды рассматривается как сумма карбонатной и некарбонатной.
Природная вода, содержащая ионы Ca2+ и Mg2+, называется жесткой. Жесткая вода при кипячении образует накипь, в ней не развариваются пищевые продукты; моющие средства не дают пены.
Различают: Временную и Постоянную жесткость
Карбонатная (временная) жесткость обусловлена присутствием в воде гидрокарбонатов кальция и магния, некарбонатная (постоянная) жесткость – хлоридов и сульфатов.
Общая жесткость воды рассматривается как сумма карбонатной и некарбонатной.
 Удаление жесткости воды осуществляется путем осаждения из раствора ионов Ca2+ и Mg2+ (см. способы устранения жёсткости воды):
1) кипячением:
Сa(HCO3)2 t˚C→ CaCO3↓+ CO2 + H2O
Mg(HCO3)2 t˚C→ MgCO3↓+ CO2 + H2O
2) добавлением известкового молока:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O
3) добавлением соды:
Ca(HCO3)2 + Na2CO3 →CaCO3↓+ 2NaHCO3
CaSO4 + Na2CO3 → CaCO3↓ + Na2SO4
MgCl2 + Na2CO3 → MgCO3↓ + 2NaCl
4) пропусканием через ионнообменную смолу
Удаление жесткости воды осуществляется путем осаждения из раствора ионов Ca2+ и Mg2+ (см. способы устранения жёсткости воды):
1) кипячением:
Сa(HCO3)2 t˚C→ CaCO3↓+ CO2 + H2O
Mg(HCO3)2 t˚C→ MgCO3↓+ CO2 + H2O
2) добавлением известкового молока:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O
3) добавлением соды:
Ca(HCO3)2 + Na2CO3 →CaCO3↓+ 2NaHCO3
CaSO4 + Na2CO3 → CaCO3↓ + Na2SO4
MgCl2 + Na2CO3 → MgCO3↓ + 2NaCl
4) пропусканием через ионнообменную смолу
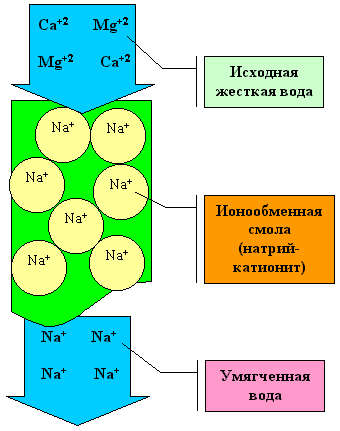 а) катионный обмен:
2RH + Ca2+ → R2Ca + 2H+
б) анионный обмен:
2ROH + SO42- → R2SO4 + 2OH-(где R - сложный органический радикал)
ТРЕНАЖЁРЫ
Тренажёр №3 "Уравнения реакций, характеризующих химические свойства оксидов магния и щелочноземельных металлов"
Тренажёр №4 " Характеристика реакции гидроксида кальция с соляной кислотой"
Тренажёр №5 " Характеристика кальция по положению в Периодической системе Д. И. Менделеева"
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Используя дополнительные источники и учебник, заполните таблицу «Соединения кальция»
а) катионный обмен:
2RH + Ca2+ → R2Ca + 2H+
б) анионный обмен:
2ROH + SO42- → R2SO4 + 2OH-(где R - сложный органический радикал)
ТРЕНАЖЁРЫ
Тренажёр №3 "Уравнения реакций, характеризующих химические свойства оксидов магния и щелочноземельных металлов"
Тренажёр №4 " Характеристика реакции гидроксида кальция с соляной кислотой"
Тренажёр №5 " Характеристика кальция по положению в Периодической системе Д. И. Менделеева"
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Используя дополнительные источники и учебник, заполните таблицу «Соединения кальция»
№2. Составьте уравнения реакций для осуществления следующих превращений:
|
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|