
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Элетродные потенциалы.
Элетродные потенциалы.
В ходе химической реакции происходит превращение химической энергии в другие виды энергии. Химическая энергия может превращаться в электрическую энергию и обратно. Наука, изучающая подобные процессы – электрохимия.
В узлах кристаллической решётки металла находятся упорядоченно расположенные частицы. Это расположение можно представить в виде кристаллической решётки. Металлы образуют металлические решётки и в её узлах находятся как положительно заряженные ионы металла, так и нейтральные атомы. Валентные электроны свободно перемещаются между узлами кристаллической решётки и их называют электронным газом. Такое строение решётки металла обуславливают некоторые общие свойства металлов: теплопроводность, электропроводность, пластичность.
Процессы, которые протекают в металле: 
Представим себе пластину металла, погружённую в раствор: 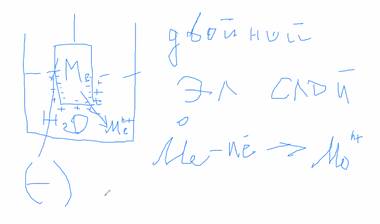
В основном металл состоит из положительно заряженных ионов (катионов), которые и будут перемещаться в раствор. При этом электроны будут оставаться на поверхности пластины. Образуется двойной электрический слой. Затем между металлом и раствором наступает динамическое равновесие и возникает разность потенциалов. Когда устанавливается равновесие, то потенциал на поверхности пластины – равновесный электродный потенциал (φ). Этот потенциал зависит от следующих факторов: типа металла (активный или неактивный), температуры. Активность или неактивность металлов определяется потенциалом ионизации металла.
Представим себе пластину активного металла, погружённую в раствор, содержащий ионы этого металла:
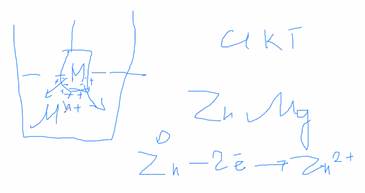
Образуется двойной электрический слой. Цинк будет переходить с электрода в раствор.
Система, состоящая из пластины металла, погружённой в раствор, называется электродом.
Представим себе пластину неактивного металла, погружённую в раствор, содержащий ионы этого металла:
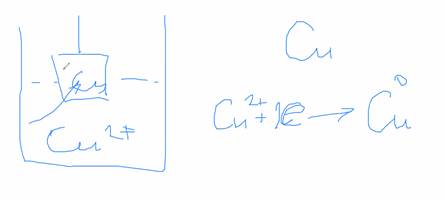
Пластина приобретает положительный заряд.

Величина заряда пластины зависит от температуры и концентрации ионов металла в растворе. Чтобы определить потенциал электрода используют уравнение Нернста.
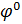 - стандартный электродный потенциал (измеряется при: Т=298К и Р=101,3 кПа)
- стандартный электродный потенциал (измеряется при: Т=298К и Р=101,3 кПа)
Стандартный электродный потенциал электрода измеряют относительно стандартного водородного электрода, потенциал которого принимают равным нулю при стандартных условиях. При этом концентрация ионов в растворе должна быть 1 моль/л.
Стандартный водородный электрод:


Значение электродного потенциала (уравнение Нернста):

Система, состоящая из 2-х электродов, называется гальваническим элементом.


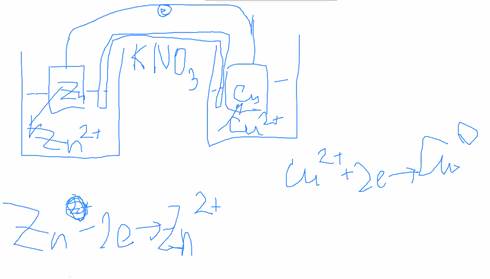
ЭДС гальванического элемента: разность электродного потенциала большего по арифметической величине электрода и меньшего.
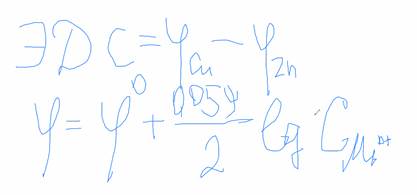


|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|