
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Ответы к заданиям 9 класса
Ответы к заданиям 9 класса
| № задания | Ответ |
| V(H2O) = 9 л | |
| V(смеси) = 2,15 л | |
| m(BeO) = 0,0625 г | |
| металл – Cr | |
| HBr | |
| М(сух. возд.) = 29 г/моль, М(влажн. возд.) = 27,9 г/моль | |
| А – NaCl, Б - HCl - хлороводород, В - соляная кислота, Г – MnO2, Д является Mn, Е - Cl2 ; n(NaCl)=2,4 моль, V(Cl2)= 13,44 л | |
| V (смеси) = 156,2 л |
ЭТАЛОНЫ РЕШЕНИЯ ЗАДАЧ (9 класс)
1. В каком объеме воды нужно растворить 6,02·1024 молекул оксида серы (VI), чтобы получить 10%-ный раствор серной кислоты?
| Решение | Баллы |
| В соответствии с законом Авогадро в 1 моль любого газа при нормальных условиях содержится 6,02·1023 частиц. Поэтому количество оксида серы (VI) составит: n (SO3) = N мол-л/N A = 6,02·1024 /6,02·1023 = 10 моль | |
| При растворении оксида серы в воде протекает реакция: SO3 + H2O → H2SO4 (1) | |
| Определим массу образовавшейся серной кислоты: По уравнению реакции (1) n(H2SO4) = n(SO3) = 10 моль m(H2SO4) = n(H2SO4) ∙ M(H2SO4) = 10 моль ∙ 98г/моль = 980 г. Масса раствора будет равна m(SO3) + m(H2O) m(SO3) = n(SO3) ∙ M(SO3) = 10 моль ∙ 80г/моль = 800 г. | |
 Приняв массу воды за х г получим:
Приняв массу воды за х г получим:
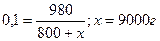  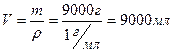 или 9 л. или 9 л.
| |
| Ответ: V(H2O) = 9 л. |
2. В смеси простых газообразных веществ число атомов хлора в 2 раза меньше числа атомов кислорода и в 3 раза больше числа атомов криптона. Какой объем при н. у. занимают 5,00 г этой смеси?
| Решение | Баллы |
Исходя из условия задачи можно обозначить:
n (Kr) – 2 моль (2 атома)
n (О2)– 6 моль (12 атомов)
n (Cl2)– 3 моль (6 атомов)
Мср = 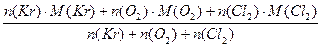 = = 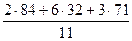 = = 52 г/моль
52 г занимают объем 22,4 л
5 г - х л
х = = = 52 г/моль
52 г занимают объем 22,4 л
5 г - х л
х = 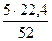 =2,15 л =2,15 л
| |
| Ответ: V(смеси) = 2,15 л. |
3. Общее число атомов в образце оксида металла IIA-группы, в котором массовая доля кислорода больше массовой доли металла, равно 3,01·1021. Вычислите массу образца оксида.
| Решение | Баллы |
| Так как металл является элементом II А группы, то формула его оксида MeO | |
| Из всех оксидов II А группы только для BeO выполняется условие ω%(О) > ω%(Me) | |
В 1 моле BeO содержится 2·6,02·1023 атомов
Определяем количество оксида металла:
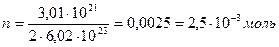 Молярная масса оксида бериллия составляет:
M(BeO) = 9 + 16 = 25 г/моль
Определяем массу ВеО:
m(BeO) = n(BeO) · M(BeO) = 0,0025моль · 25г/моль = 0,0625 г
Молярная масса оксида бериллия составляет:
M(BeO) = 9 + 16 = 25 г/моль
Определяем массу ВеО:
m(BeO) = n(BeO) · M(BeO) = 0,0025моль · 25г/моль = 0,0625 г
| |
| Ответ: m(BeO) = 0,0625 г. |
4. Относительная молекулярная масса иодида металла в 3,972 раза больше относительной молекулярной массы его фторида. Металл в обоих соединениях имеет степень окисления +3. Установите, какой это металл.
| Решение | Баллы |
| Формулы галогенидов имеют вид: MeJ3, MeF3 | |
| Обозначим М(Ме) = х, тогда М(MeJ3 )= х +127∙3 М(MeF3) = х + 19∙3 | |
тогда: 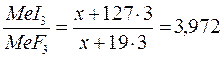
| |
| х+381=3,972(х+57) решая уравнение, получаем х=52 | |
| Молярная масса (Ме)=52 г/моль Металл – Cr | |
| Ответ: металл – Cr. |
5. Объемная доля сероводорода в его смеси с одним из галогеноводородов равна 0,20; а массовая доля водорода равна 1,676%. Какой из галогеноводородов находился в смеси?
| Решение | Баллы |
| Обозначим количество смеси – х моль, тогда: n (H2S) = 0,2x моль n (НГ) = 0,8х моль | |
| Пусть масса смеси составляет 100 г , тогда m (H) = 1,676 г отсюда m (H) = 2·0,2х + 1·0,8х = 1,676 г х = 1,4 | |
| n H2S – 0,2 · 1,4 = 0,28 моль n НГ – 0,8·1,4 = 1,12 моль | |
| М(H2S) = 34 г/моль Определяем молярную массу галогена (х): 0,28 · 34+ 1,12 · 1+ 1,12х = 100 х = 79,8 г/моль - Br | |
| Ответ: В смеси находился бромоводород HBr |
6. В сухом воздухе объемная доля азота составляет 78%, кислорода – 21%, углекислого газа – 1%. Определите среднюю молярную массу сухого воздуха и влажного воздуха, в котором объемная доля воды составляет 10%.
| Решение | Баллы |
Определяем среднюю молярную массу сухого воздуха:  M(N2) = 28 г/моль
M(O2) = 32 г/моль
M(CO2) = 44 г/моль
M(N2) = 28 г/моль
M(O2) = 32 г/моль
M(CO2) = 44 г/моль
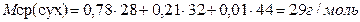
| |
| Объемная доля воды во влажном воздухе 0,1, соответственно меняются объемные доли других компонентов: φ'(N2) = 0,78 – 0,78· 0,1 = 0,78 – 0,078 φ' (O2) = 0,21 – 0,21· 0,1 = 0,21 – 0,021 φ' (CO2) = 0,01 – 0,01· 0,1 = 0,01 – 0,001. | |
Тогда справедливо выражение:
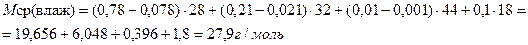
| |
| Ответ: М(сух. возд.) = 29 г/моль, М(влажн. возд.) = 27,9 г/моль. |
7. Соль А при взаимодействии с раствором нитрата серебра образует белый осадок и окрашивает пламя горелки в желтый цвет. При взаимодействии концентрированной серной кислоты с солью А при нагревании образуется газ Б, который растворили в воде. Раствор полученного вещества В полностью реагирует с 52,2 г оксида Г, содержащего 63,21 мас.% четырехвалентного металла Д с получением газа Е, способного обесцветить окрашенную влажную ткань. Определите компоненты А, Б, В, Г, Д и Е реакционной системы, количество исходной соли А и объем выделившегося газа (при н. у.)
| Решение | Баллы |
| С раствором нитрата серебра c образованием белого творожистого осадка взаимодействуют хлориды: Cl- + Ag- = AgCl ↓; пламя горелки в желтый цвет окрашивают соли Na+, следовательно, солью А является NaCl: NaCl + AgNO3 = AgCl↓ + NaNO3 (1) | |
Газом Б является HCl - хлороводород:
2NaCl + H2SO4  Na2SO4 + 2HCl↑ (2) Na2SO4 + 2HCl↑ (2)
| |
| Веществом В является раствор газа HCl в воде – соляная кислота. | |
Оксид Г четырехвалентного металла Д имеет формулу ДО2. Определим атомную массу металла Д из соотношения
 откуда Ar(Д)=55 г/моль.
откуда Ar(Д)=55 г/моль.
| |
| Искомым металлом Д является Mn, а искомым оксидом Г – MnO2. | |
| MnO2 реагирует с соляной кислотой по следующей схеме: MnO2 +4HCl = MnCl2 + Cl2↑ + 2H2O (3) MnO2 +4H+ + 2ē → Mn2+ + 2H2O 1 2Cl- - 2ē → Cl2 1 | |
| Таким образом, газом Е является хлор, который может обесцветить окрашенную влажную ткань. | |
Массе MnO2 52,2 г соответствует его количество, равное
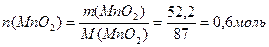
| |
| Количество газа Cl2 в соответствии с уравнением (3) равно количеству MnO2: n(Cl2) = n(MnO2) = 0,6 моль | |
| Это количество соответствует объему газа (при н.у.) равному V(Cl2) = n(Cl2) Vm = 0,6 × 22,4 = 13,44 л | |
| В соответствии с уравнением (3) n(HCl) = 4n(MnO2) = 4×0,6 = 2,4моль. | |
| Такое же количество NaCl в соответствии с уравнением (2) требуется для получения этого количества HСl, Таким образом n(NaCl)=2,4 моль. | |
| Ответ: А – NaCl, Б - HCl - хлороводород, В - соляная кислота, Г – MnO2, Д является Mn, Е - Cl2 ; n(NaCl)=2,4 моль, V(Cl2)= 13,44 л. |
8. Сколько дм3 (н.у.) смеси оксида серы (IV) и азота (содержание оксида серы (IV) составляет 20% по массе) надо пропустить через 500 г 8% раствора натрия гидроксида, чтобы массовые доли полученных при этом солей стали одинаковы?
| Решение | Баллы |
| Если ω (SO2 )– 20%, то ω (N2)– 80% | |
| Определим количество вещества гидроксида натрия в растворе: m(NaOH)=500×0,08=40г M(NaOH)= 40г/моль n(NaOH) = m/M = 40г/40 г/моль = 1 моль | |
| M(NaHSO3)= 104г/моль M(Na2SO3)= 126г/моль M(Na2SO3)> M(NaHSO3), Коэффициент пересчета M(Na2SO3)/M(NaHSO3) = 126/104 = =1,21154 ≈ 1,2 | |
| Пусть в ходе реакции образовалось х моль Na2SO3 тогда в ходе реакции образовалось 1,2х NaHSO3 , т.к. по условию задачи m(Na2SO3)= m(NaHSO3) | |
| 1,2 х 1,2х 1,2х NaOH + SO2 → NaHSO3 (1) 2х х х 2NaOH + SO2 → Na2SO3 + Н2О (2) Пусть в реакцию (1) вступило 1,2х моль NaOH в реакцию (2) вступило 2х моль NaOH | |
| Составим уравнение: 1,2х+2х=1,0 моль; х=0,3125 | |
| n(Na2SO3)=0,3125 моль n(NaHSO3)=1,2×0,3125=0,375 моль | |
| Количество SO2, вступившего в реакции (а) и (б): n(SO2) = х + 1,2х = 0,6875 моль m(SO2) = n · M = 0,6875моль · 64 г/моль = 44г | |
Определяем массу N2
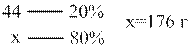
| |
| Определяем количество N2 n(N2)= m/M = 176г/28г/моль = 6,2857 моль | |
| Определяем количество газа в смеси nгаза = 6,2857 + 0,6875 = 6,97 моль | |
| Определяем объем газовой смеси V = n × Vm = 6,97моль × 22,4 л/моль = 156,2 л | |
| Ответ: V (смеси) = 156,2 л |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|