
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тема урока: СОЛИ АММОНИЯ И ИХ СВОЙСТВА (ТЕРМИЧЕСКОЕ РАЗЛОЖЕНИЕ, ВЗАИМОДЕЙСТВИЕ СО ЩЕЛОЧАМИ). АММИАЧНАЯ СЕЛИТРА КАК УДОБРЕНИЕ И ОКИСЛИТЕЛЬ
Тема урока: СОЛИ АММОНИЯ И ИХ СВОЙСТВА (ТЕРМИЧЕСКОЕ РАЗЛОЖЕНИЕ, ВЗАИМОДЕЙСТВИЕ СО ЩЕЛОЧАМИ). АММИАЧНАЯ СЕЛИТРА КАК УДОБРЕНИЕ И ОКИСЛИТЕЛЬ
Цель урока: изучить соли аммония и их свойства.
Соли аммония - это сложные вещества, в состав которых входят ионы аммония NH4+, соединённые с кислотными остатками.
Например:
NH4Cl – хлорид аммония
(NH4)2SO4 - сульфат аммония
NH4NO3 – нитрат аммония
(NH4)3PO4 – ортофосфат аммония
(NH4)2HPO4 – гидроортофосфат аммония
NH4H2PO4 – дигидроортофосфат аммония
Физические свойства
Кристаллические вещества, хорошо растворимые в воде.
Получение
1 способ- Аммиак + кислота: NH3 + HNO3 → NH4NO3
2 способ- Аммиачная вода + кислота: 2NH4OH + H2SO4 → (NH4)2SO4+ 2Н2O
Химические свойства
ОБЩИЕ
1. Сильные электролиты (диссоциируют в водных растворах)
NH4Cl → NH4+ + Cl-
2. С кислотами (реакция обмена)
(NH4)2CO3 + 2НCl → 2NH4Cl + Н2O + CO2
2NH4+ + CO32- + 2H+ + 2Cl- → 2NH4+ + 2Cl- + Н2O + CO2
CO32- + 2H+ → Н2O + CO2
3. С солями (реакция обмена)
(NH4)2SO4 + Ba(NO3)2 → BaSO4↓ + 2NH4NO3
2NH4+ + SO42- + Ba2+ + 2NO3- → BaSO4 ↓ + 2NH4+ + 2NO3-
Ba2+ + SO42- → BaSO4 ↓
СПЕЦИФИЧЕСКИЕ
1. Разложение при нагревании.
a) если кислота летучая
NH4Cl → NH3 + HCl (при нагревании)
NH4HCO3 → NH3 + Н2O + CO2
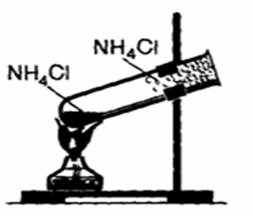
Рис.1. Разложение хлорида аммония
б) если анион проявляет окислительные свойства
NH4NO3 → N2O + 2Н2O (при нагревании)
(NH4)2Cr2O7 → N2 + Cr2O3 + 4Н2O (при нагревании)
2. Качественная реакция на NH4+ - ион аммония. При нагревании со щелочами выделяется газ аммиак
NH4Cl + NaOH → NaCl + NH3 + Н2O (при нагревании)
3. Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) – среда кислая:
NH4Cl + Н2O → NH4OH + HCl
NH4+ + Н2O → NH4OH + H+
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|