
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тема лекции: спирты в группе ИС-9-6, преподаватель Толокнова Т.Н.
Тема лекции: спирты в группе ИС-9-6, преподаватель Толокнова Т.Н.
План лекции
1. Общее понятия.
2. Групповой реактив.
3.Характеристика соединений.
1. Общее понятия
Вторую аналитическую группу составляют катионы Ag+, Pb2+, Hg22+. Элементы, соответствующие этим катионам, находятся в разных группах периодической системы Д. И. Менделеева. Ag+ и Hg22+ (катионы d - элементов) имеют электронную формулу внешнего энергетического уровня соответственно 4s24p24d10 (Ag+) и 5s25p65d10 (Hg+), т.е. устойчивый 18-электронный внешний энергетический уровень. Рb2+ - катион р-элемента, электронная формула внешнего энергетического уровня 6s2, предыдущий 5-й уровень имеет 18 электронов.
2. Групповой реактив
Эти катионы образуют нерастворимые в воде хлориды, поэтому групповым реактивом II группы является хлороводородная кислота НС1. Растворимость хлоридов различна. При стандартной температуре 298 К РAgCl = 1,3 ∙ 10-5 моль/дм3, PPbCl 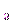 = 4 ∙ 10-2 моль/ дм3, PHg
= 4 ∙ 10-2 моль/ дм3, PHg 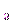 Cl
Cl 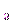 = 6,9 ∙ 10-7 моль/ дм3. Растворимость РbС12 наибольшая. Она значительно увеличивается при повышении температуры и при 373 К достигает 1,2 ∙ 10-1 моль/ дм3. Это свойство хлорида свинца дает возможность отделять РbС12 от AgCl и Hg2Cl2.
= 6,9 ∙ 10-7 моль/ дм3. Растворимость РbС12 наибольшая. Она значительно увеличивается при повышении температуры и при 373 К достигает 1,2 ∙ 10-1 моль/ дм3. Это свойство хлорида свинца дает возможность отделять РbС12 от AgCl и Hg2Cl2.
Большая растворимость РbС12 не позволяет практически полностью осадить катионы Рb2+ из раствора при действии НС1. Поэтому при анализе смеси катионов нескольких групп ион Рb2+ осаждается серной кислотой и частично попадает в III группу.
Большинство солей катионов II группы нерастворимы в воде. Растворимы лишь нитраты этих катионов и ацетаты серебра и свинца.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|