
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Справочный материал. Амфотерные cоединения могут реагировать с щелочами двояко: в растворе и врасплаве
Справочный материал
Амфотерные cоединения могут реагировать с щелочами двояко: в растворе и врасплаве
| (раствор) 2Al+2NaOH+6Н2О = 2Na[Al(OH)4] + 3H2 2Al + 2NaOH (конц. ) + 6H2O (гор. ) = 2Na[Al(OH)4] + 3H2↑ (cплавление) 2Al+6NaOH = 2Na3AlO3 + 3H2 2Al + 2NaOH -> 2NaAlO2 + H2 (раствор) Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] (В данном случае образуется тетрагидроксоалюминат натрия) (при сплавлении) Al(OH)3 + NaOH = NaAlO2 + 2 H2O (при добавлении раствора NaOH без нагревания). Al(OH)3 + NaOH = Na[Al(OH)4] | 4K2Cr2O7 → 2Cr2O3 + 4K2CrO4 + 3O2↑, Al2O3+Na2CO3(t) =2NaAlO2+CO2 (без окислителя) NaAlO2+4HCl=NaCl+AlCl3+2H2O Fe2O3+Na2CO3(t) =2NaFeO2+CO2 2MgCl2 + 2Na2CO3 + H2O = [Mg(OH)]2CO3 + CO2 + 4NaCl AgCl + 2NH3 = [Ag(NH3)2]Cl Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2 CuSO4 + 4NH3 = [Cu(NH3)4]SO4 Cr2O3+3KNO3+2Na2CO3→2Na2CrO4+3KNO2+2CO2↑.(с окислителем) |
| (раствор) Zn + 2 NaOH + 2 H2O = Na2[Zn(OH)4] + H2 (cплавление) Zn + 2NaOH ----> Na2ZnO2 + H2 Реакция в растворе: ZnO + 2NaOH + H2O = Na2[Zn(OH)4] Реакция при сплавлении: 2NaOH + ZnO = Na2ZnO2 + H2O Реакция в растворе: Zn(OH)2 + 2NaOH = Na2[Zn(OH)4] Реакция при сплавлении: Zn(OH)2 + 2NaOH ----> Na2ZnO2 + H2O | 2KMnO4 = K2MnO4 + MnO2 + O2↑ MnO2 + 4 НСl(конц.) = MnСl2 + Сl2↑ + 2 H2O 2KMnO4+16HCl => 2MnCl2 + 2KCl+5Cl2↑+8H2O K2MnO4 + 8HCl --> MnCl2 + 2Cl2 + 2KCl + 4H2O В присутствии катализаторов(MnO2, ) 2KClO3 = 2KCl + 3O2↑ При температуре ~ 400 4KClO3 = 3KClO4 + KCl 400 °C); KClO4 = KCl + 2O2↑ (550—620 °C) 2KClO=2KCl+O2 (катализатор) 3KClO=2KCl+ KClO3(при нагрев) |
Реакция в растворе:
2Сr+2NaOH+6Н2О = 2Na[Cr(OH)4] + 3H2
Реакция при сплавлении:
2Cr + 2NaOH -> 2NaCrO2 + H2
Реакция в растворе: (в отсутствие окислителей)
Cr2O3 + 2NaOH + 3H2O → 2Na[Cr(OH)4]
Реакция при сплавлении:
Cr2O3 + 2KOH → 2KCrO2 + H2O,
Реакция в растворе:
2Cr(OH)3 + 3NaOH = Na3[Cr(OH)6)]
Реакция при сплавлении:
Cr(OH)3 + NaOH = NaCrO2 + 2H2O
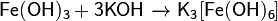 2Fe+2NaOH+6Н2О≠
2Fe+2NaOH+6Н2О≠
| KClO3бертолетовая соль Na4P2O7пирофосфат K2Cr2O7- Это K2CrO4 +CrO3 K2CrO4 -жёлтый K2Cr2O7-оранжевый Cr(OH)3Светло зелёный Cr2O3-зелёный KMnO4 -фиолетовыя MnCl2 -бесцветная K2MnO4 -тёмно-зелёная (разложение) дихромата аммония Реакция сопровождается выбросом раскалённых докрасна твёрдых частиц – искр- оксида хрома (III) (после остывания они зелёного цвета) (NH4)2Cr2O7=Cr2O3 +N2 +4H2O |
| K2[Zn(OH)4]+2HCl(нед.)=2KCl+Zn(OH)2 + 2H2O K2[Zn(OH)4]+4HCl(изб.)=2KCl+ZnСl2 + 4H2O Разлагается при нагревании: K2[Zn(OH)4]= ZnO+ NaOH+ H2O В водных растворах разлагается: K2[Zn(OH)4]= K2ZnO2+ H2O (темп. бол 300 ) или ZnO + 2КOH + H2O K2[Zn(OH)4]+Cl2=KCl+KClO+Zn(OH)2+H2O K2[Zn(OH)4]+CO2= Na2CO3 + Zn(OH)2+ H2O | Используется для поглощения углекислого газа и обогащения воздуха кислородом в подводных лодках космических кораблях 2Na2O2 + 2CO2 = 2Na2CO3+ O2 K2C2O4 + H2SO4 = CO + CO2 + K2SO4 + H2O (или KНSO4) |
.
| Щёлочи + неметаллы Только щелочи взаимодействуют с некоторыми неметаллами (Si, S, P, F2, Cl2, Br2, I2). При этом часто в результате диспропорционирования образуются две соли, например: Si + 2KOH + H2O= K2SiO3 + 2H2, Сера S, селен Se и теллур Te растворяются в концентрированном растворе щелочи: При н.у. 4S + 6KOH =2K2S + K2S2O3 + 3H2O, K2S2O3-тиосульфат При нагревании и когда щёлочь концентрирован 3S + 6KOH =2K2S + K2SO3 + 3H2O, 3Se + 6NaOH = Na₂SeO₃ + 2Na₂Se + 3H₂O 3Te + 6NaOH = Na₂TeO₃ + 2Na₂Te + 3H₂O Хлор Cl₂ различно реагирует со щелочью при различных температурах: Cl2 + 2KOH (конц. ) = KCl + KClO + H2O, (на холоде); KClO-гипохлорит (При нагревании) 3Cl2 + 6KOH (конц. ) = 5KCl + KClO3 + 3H2O, KClO3-хлорат калия, бертолетовая соль Cl2 + Ca(OH)2 = CaOCl2 + H2O, Бром Br₂ и йод I₂ реагируют единственным образом: 3Br₂ + 6NaOH = 5NaBr + NaBrO₃ + 3H₂O 3I₂ + 6NaOH = 5NaI + NaIO₃ + 3H₂O 4F2 + 6NaOH (разб. ) = 6NaF + OF2+ О2+ 3H2O, При нагревании 4P + 3NaOH + 3H2O = 3NaH2PO2 + PH3. Белый фосфор P₄ также растворим в концентрированной щелочи: Р4+ 3NaOH + 3H2O = 3NaH₂PO₂ + PH₃ |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|