
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Лабораторная работа № 4. Тема: Перманганатная окисляемость воды по методу Кубеля. Методические рекомендации. Чистая 2-2,9 мг/ л. Ход определения
Лабораторная работа № 4
Тема: Перманганатная окисляемость воды по методу Кубеля
Цель работы: Определить перманганатную окисляемость воды по методу Кубеля
Реактивы и оборудование:дистиллированная и анализируемая воды; серная кислота, раствор 1:3; щавелевая кислота 0.01Н р-р; перманганат калия 0.01Н р-р; коническая колба, пипетка Мора на 100 см3, мерная пробирка, плитка, стеклянная воронка, бюретка.
Методические рекомендации
Метод Кубеля основан на окислении веществ, присутствующих в пробе воды, раствором перманганата калия в сернокислой среде при кипячении. Реакция протекает следующим образом:
2 KMnO4+ 5H2C2O4+ 3H2SO4= 2MnSO4+K2SO4+ 10CO2+ 8H2O
Без разбавления можно определить окисляемость до 10 мг О2/дм3. Наивысшее допустимое разбавление проб – десятикратное. Это означает, что метод можно использовать только для проб, окисляемость которых ниже 100 мг О2/дм3.
Шкала оценки расхода кислорода на окисление примесей.
Очень чистая до 1 мг/ л
Чистая 2-2,9 мг/ л
Умеренно грязная 3 – 3,9мг/ л
Загрязнённая 4-4,9 мг/л
Грязная 5-15 мг/л
Очень грязная более 15 мг/л
Ход определения
Анализ пробы воды. В коническую колбу на 200-250 см3наливают пипеткой 100 см3испытуемой воды. Прибавляют 5 см3раствора серной кислоты (1:3) и ставят на плитку. При появлении первых пузырьков (начало кипения) в пробу добавляют из бюретки точно 10 см30,01 Н раствора перманганата калия. После этого пробу кипятят на малом огне 10 минут. Колбу при кипячении прикрывают стеклянной воронкой, которая выполняет функцию обратного холодильника. Если во время кипячения исследуемая вода обесцветилась или потеряла характерную малиновую окраску перманганата калия, определение надо начать сначала, предварительно разбавив исследуемую воду дистиллированной водой.
По окончании кипячения пробу снимают с огня и в нее добавляют из бюретки точно 10 см30,01 Н раствора щавелевой кислоты С2Н2О4. Обесцветившуюся горячую жидкость оттитровывают 0,01 Н раствором KMnO4 до появления слабо-розового оттенка.
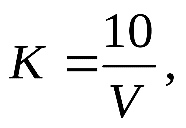 Стандартизация титранта. Стандартизация титранта проводится одновременно с анализом. В только что оттитрованную пробу, имеющую температуру около 50 – 60ºС, снова прибавляют 10 см30,01 н раствора щавелевой кислоты и снова титруют раствором перманганата калия до появления слабо-розовой окраски. Поправку к титру раствора KMnO4 определяют из соотношения:
Стандартизация титранта. Стандартизация титранта проводится одновременно с анализом. В только что оттитрованную пробу, имеющую температуру около 50 – 60ºС, снова прибавляют 10 см30,01 н раствора щавелевой кислоты и снова титруют раствором перманганата калия до появления слабо-розовой окраски. Поправку к титру раствора KMnO4 определяют из соотношения:
где К – поправочный коэффициент к концентрации титранта;
10 – объем раствора щавелевой кислоты, см3;
V– объем раствора перманганата калия, см3. 2мл
Определение перманганатной окисляемости при разведении воды. При разведении испытуемой воды дистиллированной при подсчете окисляемости вводят поправку на дистиллированную воду. Для этого проводят все определения со 100 см3дистиллированной воды совершенно так же, как и с исследуемой водой. Объем раствора перманганата калия (в см3), пошедший на окисление дистиллированной воды, при подсчете окисляемости вычитают из объема раствораKMnO4, израсходованного на окисление пробы.
Расчет. Перманганатную окисляемость Х в мг О2 /дм3 рассчитывают по формуле
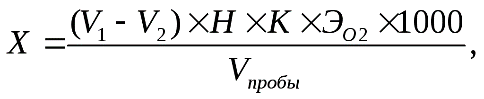
где V1 - объем раствора перманганата калия, пошедшего на титрование пробы, см3; 2 мл
V2 – объем раствора перманганата, пошедшего на титрование дистиллированной воды, см3; 0,8 мл
Н – концентрация титранта – перманганата калия, моль-экв/дм3; 0,01Н
К – поправочный коэффициент к концентрации титранта;
ЭО2– эквивалент кислорода, 8 г/моль-экв.;
Vпробы – объем анализируемой воды, см3;100 мл
1000 – коэффициент для перехода от граммов к миллиграммам.
---------------------------------------------------------------------------------------------------
Рассчитать и сделать вывод о качестве воды по шкале
Контрольные вопросы
1. Температура воды измеряется с помощью
А. водного гигрометра
Б. водного термометра
В. водного реостата
2. Прозрачность воды зависит
А. от количества растворенных в ней веществ, содержания механических частиц и коллоидов.
Б. от количества взвешенных в ней веществ, содержания аналитических веществ.
В. присутствия в воде ионов кальция (Са2+) и магния (Мд2+).
3. Цветводы зависит
А. от химического состава, наличия микроорганизмов, частиц ила, глины и
других примесей.
Б. от наличия микрочастиц, частиц грунта, перегноя и примесей животного
происхождения.
В. от химической однородности, минерализации и кислорода, растворенного в
ней.
4. Химические показатели воды включают
А. Водородный показатель. Сухой остаток. Жесткость воды. Окисляемость
Биохимическое потребление кислорода
Б. Водородный показатель. Жесткость воды. Окисляемость. Минерализация
В. Биохимическое потребление кислорода. Окисляемость. Кислотность.
5. Общая минерализация —
А. показатель количества содержащихся в воде растворенных неорганических солей и органических веществ.
Б. показатель содержащихся в воде неорганических солей.
В. показатель содержащихся в воде органических веществ.
Ответы
1-
2-
3-
4-
5-
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|