
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Решение расчетных задач.. Выведите молекулярную формулу вещества, если массовая доля углерода в нём составляет 82,75%, водорода 17,25%. Относительная плотность паров по воздуху равна 2.. Относительная плотность паров органического соединения по водороду р
Решение расчетных задач.
1. Выведите молекулярную формулу вещества, если массовая доля углерода в нём составляет 82,75%, водорода 17,25%. Относительная плотность паров по воздуху равна 2.
| Дано: | Решение: |
| Dвозд(CxHy) = 2 ω(C) = 82,75% ω(H) = 17,25% | 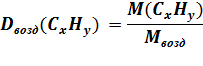 Mвозд = 29 г/моль
M(CxHy) = 29 г/моль ∙ 2 = 58 г/моль
Пусть ν(CxHy) = 1 моль, тогда m(CxHy) = 58 г
Mвозд = 29 г/моль
M(CxHy) = 29 г/моль ∙ 2 = 58 г/моль
Пусть ν(CxHy) = 1 моль, тогда m(CxHy) = 58 г
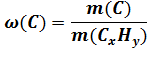 m(C) = 0,8275 ∙ 58г = 47,995 ≈ 48г
m(H) = 0,1725 ∙ 58г = 10,005 ≈ 10г
ν(C) : ν(H) =
m(C) = 0,8275 ∙ 58г = 47,995 ≈ 48г
m(H) = 0,1725 ∙ 58г = 10,005 ≈ 10г
ν(C) : ν(H) =  = 4 : 10 ⇒ С4Н10
M(C4H10) = 48 + 10 = 58 г/моль = 4 : 10 ⇒ С4Н10
M(C4H10) = 48 + 10 = 58 г/моль
|
| CxHy – ? | Ответ: С4Н10 |
2. Относительная плотность паров органического соединения по водороду равна 71. При сжигании 2,84г этого вещества образуется 4,48л углекислого газа и 3,96г воды. Выведите молекулярную формулу этого соединения.
 |
Дано:
DH2(CxHy)= 71
m(CxHy)=2,84г
m(СO2)=4,48 л
m(H2O)=3,96 г

CxHy - ?
М(CxHy) = DH2(CxHy) * М(H2) = 71*2г/моль=142г/моль
Х2 4,48л

 C CO2 x= 12г * 4,48л = 2,4г
C CO2 x= 12г * 4,48л = 2,4г
12г 22,4л 22,4л
Y2 3,96г

 2Н Н2О y = 2г * 36г = 0,44г
2Н Н2О y = 2г * 36г = 0,44г
2г 18г 18г
х + у = m(С) + m(H) = 2,4г + 0,44г = 2,84г

 V(С) :V(H) = 2,4г : 0,44г = 0,2 : 0,44= 10 :22
V(С) :V(H) = 2,4г : 0,44г = 0,2 : 0,44= 10 :22
12г/моль 1г/моль
C10H22-простейшая формула
М(C10H22) =120+22=142 г/моль
Ответ: C10H22
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|