
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Расчетная работа
Министерство образования и науки РФ
Федеральное государственное бюджетное образовательное учреждение
высшего образования
«Пермский национальный исследовательский
политехнический университет»
Березниковский филиал
Кафедра Химической технологии и экологии
Расчетная работа
по дисциплине «Физическая химия»
Выполнил: студент гр. ТМО – 16з
Иванов В. В.
Проверил: ст. преподаватель
Середкина О. Р.
Березники 2018
Задание: Определить ΔH, ΔU, ΔS, ΔG, ΔF реакции при постоянном давлении
Р = 1,013 ∙ 105 Па, стандартной и заданной температуре Т = 550К.
BaO(кр) + H2SO4(ж) = BaSO4(кр) + H2O(г)
| Вещество | ΔH0f,298, кДж/моль | ΔS0298, Дж/моль ∙ К | ΔG0f,298, кДж/моль | Коэффициенты уравнения С0р = f (T) | ||
| a | b ∙ 103 | cꞋ ∙10-5 | ||||
| BaSO4(кр) | -1458,58 | 132,21 | -1348,43 | 141,42 | -35,27 | |
| H2O(г) | -241,81 | 188,72 | -228,61 | 10,71 | 0,33 | |
| BaO(кр) | -553,54 | 70,29 | -552,84 | 53,30 | 4,35 | -8,28 |
| H2SO4(ж) | -813,99 | 156,90 | -690,14 | 156,90 | 28,30 | -23,46 |
Определение теплового эффекта
Изобарный процесс
1. При Т = 298К
ΔH0r,298 = ∑ (n ∙ ΔH0r,298)продукта - ∑ (n ∙ ΔH0r,298)исходных
ΔH0r,298 = (-1458,88 + (-241,81)) – ((-553,54) + (-813,99)) = -333,16 кДж/моль.
Вывод: при изобарном процессе и при стандартных условиях процесс экзотермический.
2. При Т = 550К
Δa = (141,42 + 30) – (53,30 + 156,90) = -38,78
Δb = (0 + 10,71) – (4,35 + 28,30) = -21,94 ∙10-3
ΔсꞋ = (-35,27 + 0,33) – (-8,28 + (-23,46)) = -3,2 ∙ 105
ΔHr,550 = ΔH0r,298 + Δa ∙ (550-298) + ½ ∙ Δb ∙ (Т2 – 2982) + ΔсꞋ ∙ ( 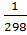 -
-  ) =
) =
= -333, 16 ∙ 103 + (-38,78) ∙ (550-298) + ½ ∙ (-21,94 ∙ 10-3) ∙ (5502 – 2982) + (3,2 ∙ 105) ∙ ( 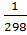 -
- 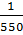 ) = -345 769,605 Дж/моль = -345,77 кДж/моль.
) = -345 769,605 Дж/моль = -345,77 кДж/моль.
Вывод: при изобарном процессе и при Т = 550К энергия выделяется, процесс экзотермический.
Изохорный процесс
1. При Т = 298К
ΔU0r,298 = ΔH0r,298 – Δn ∙ R ∙ T
ΔU0r,298 = -333,16 – 1 ∙ 8,314 ∙10-3 ∙ 298 = -335,637 кДж/моль.
Вывод: при изохорном процессе и при стандартных условиях, внутренняя энергия не изменяется, процесс экзотермический, протекает с выделением тепла.
2. При Т = 550К
ΔUr,550 = ΔHr,550 – Δn ∙ R ∙ T
ΔUr,550 = -345,77 – 1 ∙ 8, 314 ∙ 10-3 ∙ 550 = -350,342 кДж/моль.
Вывод: при изохорном процессе и при Т = 550К тепловой эффект реакции увеличивается, реакция осталась экзотермической.
Определение направления протекания процесса
Изолированная система
1. При Т = 298К
ΔS0r,298 = ∑ (n ∙ ΔS0r,298)продукта - ∑ (n ∙ ΔS0r,298)исходных
ΔS0r,298 = (132,21 + 188,72) – (70,29 + 156,90) = 93,74 кДж/моль ∙ К .
Вывод: в изолированной системе при стандартных условиях изменение энтропии системы, процесс будет протекать самопроизвольно.
2. При Т = 550К
ΔSr,550 = ΔS0r,298 + Δa ∙ ln  + Δb ∙ (Т – 298) + ½ ∙ ΔсꞋ ∙ (
+ Δb ∙ (Т – 298) + ½ ∙ ΔсꞋ ∙ (  -
- 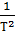 ) =
) =
= 93,74 + (-38,78) ∙ ln 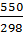 + (-21,94 ∙ 10-3) ∙ (550 – 298) + ½ ∙ (-3,2 ∙ 105) ∙ (
+ (-21,94 ∙ 10-3) ∙ (550 – 298) + ½ ∙ (-3,2 ∙ 105) ∙ (  -
- 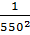 ) = 63,205 Дж/моль ∙ К.
) = 63,205 Дж/моль ∙ К.
Вывод: в изолированной системе при Т = 550К энтропия, процесс будет протекать самопроизвольно.
Закрытая система
Изобарно – изотермический процесс
1. При Т = 298К
ΔG0r,298 = ΔH0r,298 – Т ∙ ΔS0r,298
ΔG0r,298 = -333,16 – 298 ∙ 93,74 ∙ 10-3 = -361,094 кДж/моль.
ΔG0r,298 = ∑ (n ∙ ΔG0r,298)продукта - ∑ (n ∙ ΔG0r,298)исходных
ΔG0r,298 = (-1348,43 + (-228,61)) – ((-525,84) + (-690,14)) = -361,06 кДж/моль
Вывод: в закрытой системе при стандартных условиях изобарно – термический процесс протекает самопроизвольно.
2. При Т = 550К
ΔGr,550 = ΔHr,550 – Т ∙ ΔSr,550
ΔGr,550 = -345,77 – 550 ∙ 63,205 ∙ 10-3 = -380,532 кДж/моль.
Вывод: в закрытой системе при Т = 550 изобарно – изотермический процесс протекает самопроизвольно.
Изохорно – изотермический процесс
1. При Т = 298К
ΔF0r,298 = ΔU0r,298 – Т ∙ ΔS0r,298
ΔF0r,298 = -335,637 – 298 ∙ 93,74 ∙ 10-3 = -363,571 кДж/моль.
ΔF0r,298 = ΔG0r,298 – Δn ∙ R ∙ T
ΔF0r,298 = -361,06 – 1 ∙ 8,314 ∙ 10-3 ∙ 298 = -363,537 кДж/моль.
Вывод: в закрытой системе изохорно – изотермический процесс протекает самопроизвольно.
2. При Т = 550К
ΔFr,550 = ΔUr,550 – Т ∙ ΔSr,550
ΔFr,550 = -350,342 – 550 ∙ 63,205 ∙ 10-3 = -385,104 кДж/моль.
ΔFr,550 = ΔGr,550 – Δn ∙ R ∙ T
ΔFr,550 = -380,532 – 1 ∙ 8,314 ∙ 10-3 ∙ 550 = -385,104 кДж/моль.
Вывод: в закрытой системе при Т = 550К изохорно – изотермический процесс протекает самопроизвольно.
Результаты:
| Температура, К | ΔHr, кДж/моль | ΔUr, кДж/моль | ΔSr, Дж/моль | ΔGr, кДж/моль | ΔFr, кДж/моль |
| -333,16 | -335,637 | 93,74 | -361,094 | -363,571 | |
| -345,77 | -350,342 | 63,205 | -380,532 | -385,104 |
Вывод:В данном температурном интервале процесс является экзотермическим, как при постоянном давлении, так и при постоянном объеме. В изолированной и закрытой системе процесс протекает самопроизвольно.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|