
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Основные сведения о строении атома. Состав атомных ядер
Основные сведения о строении атома. Состав атомных ядер
«Химия – это область чудес, в ней скрыто счастье человечества, величайшие завоевания разума будут сделаны именно в этой области».
А.М. Горький
Наиболее точную и полную модель строения атома предложил Эрнест Резерфорд, хотя понятие «атом» было известно еще в античном мире. Свою модель строения атома ученый назвал планетарной, потому что атом как крошечная Солнечная система, в центре которого ядро, а вокруг ядра вращаются электроны.
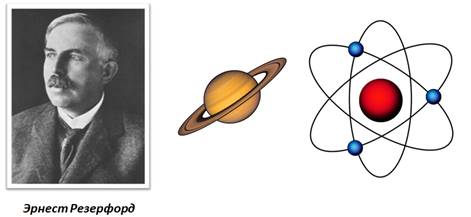
Крошечное ядро состоит из элементарных частиц – протонов и нейтронов. Рассмотрим таблицу, в которой указан символ этой частицы, её масса и заряд.
Состав ядра
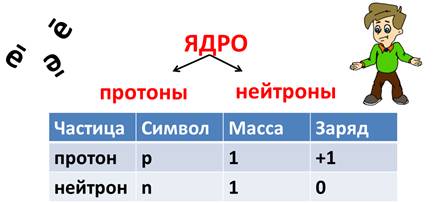
Из таблицы видно, что протон имеет заряд +1, масса протона равна 1, как и у водорода, поэтому он имеет символ р. Нейтроны тоже имеют массу равную 1, не имеют заряда, он равен 0 и обозначаются буквой n. Электроны обозначаются буквой е, заряд их равен -1, т.к. масса их ничтожна мала, то ей можно пренебречь.
Сумма чисел протонов и нейтронов называется массовым числом и обозначается буквой А, которая численно равна относительной атомной массе, округленной до целого значения.
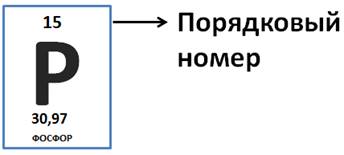
Для того чтобы определить число протонов и электронов, достаточно знать порядковый номер элемента. Например, у атома фосфора порядковый номер 15, значит у него 15 протонов в ядре, 15 электронов в атоме.
Для нахождения числа нейтронов можно использовать следующую формулу:
N = A–Z
т.к. A = Z + N, где N– число нейтронов, а Z – число протонов.
Несмотря на то, что атом очень малы, швейцарские учёные Биннинг и Рорерс помощью сканирующего микроскопа смогли увидеть реальные молекулы и атомы, в последствие им дали Нобелевскую премию за это достижение. Сканирующие микроскопы могут увеличивать объект в 100 млн. раз, т.е. позволяет увидеть частицы размером всего 10-9 м. Такие частицы называются наночастицами.

|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|