
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Решение расчётных задач по химии.
Решение расчётных задач по химии.
В ответе запишите уравнение реакции, о которой идёт речь в условии задачи,
и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
№1. Через 175 г раствора серной кислоты с массовой долей кислоты 14% пропустили аммиак до образования сульфата аммония. Вычислите объём (н.у.) вступившего в реакцию газа. (ответ 11,2 л)
№ 2.После пропускания через раствор гидроксида натрия 2,24 л сернистого газа (н.у.) получили 252 г раствора сульфита натрия. Вычислите массовую долю соли в полученном растворе. ( ответ 5%)
№ 3.При взаимодействии 7,1 г оксида фосфора(V) с избытком раствора гидроксида натрия получили 164 г раствора средней соли. Вычислите массовую долю соли в полученном растворе ( ответ 10 %)
№ 4.При пропускании 4,48 л углекислого газа (н.у.) через раствор гидроксида бария с массовой долей щёлочи 12% образовался карбонат бария. Вычислите массу исходного раствора гидроксида бария (ответ 285 г)
№5. После пропускания 4,4 г углекислого газа через 320 г раствора гидроксида калия получили раствор средней соли. Вычислите массовую долю щёлочи в исходном растворе. (3,5 %)
№6.Через раствор серной кислоты пропустили 0,224 л аммиака. Образовалось 13,2 г раствора сульфата аммония. Вычислите массовую долю соли в полученном растворе.
№7. К 150 г раствора гидроксида бария добавляли серную кислоту до прекращения выпадения осадка. Масса осадка составила 4,66 г. Рассчитайте массовую долю гидроксида бария в исходном растворе.
№8.К 57,1 г раствора сульфата железа(III) с массовой долей соли 7,0% добавили избыток раствора хлорида бария. Определите массу выпавшего осадка. (ответ 6,99 г)
№9.К 27 г раствора с массовой долей хлорида меди(II) 10% добавили избыток раствора сульфида натрия. Определите массу выпавшего осадка.



 №10.Через 40 г раствора с массовой долей гидроксида натрия 6% пропустили углекислый газ до образования карбоната натрия. Вычислите объём (н.у.) вступившего в реакцию газа(0,672).
№10.Через 40 г раствора с массовой долей гидроксида натрия 6% пропустили углекислый газ до образования карбоната натрия. Вычислите объём (н.у.) вступившего в реакцию газа(0,672).
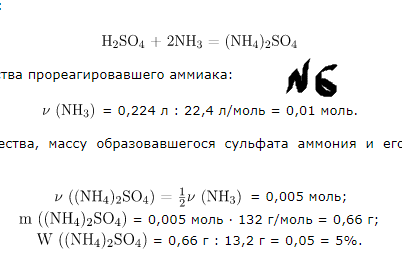



№8 №9 нет
4г хг №8
Fe2(SO4)3 + 3BaCl2=3BaSO4+2FeCl3
400г 699г
м в-ва = м р-ра *ω/100%
м в-ва Fe2(SO4)3)= 57,1 * 7%/100%=3,997г≈4г
х= 4*699/400=6,99г m(BaSO4)
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|