
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Катодные процессы. Анодные процессы
Катодные процессы
| LiKCaNaMgAl Li+K+Ca2+Na+Mg2+Al3+ | MnZnFeNiSnPb Mn2+Zn2+Fe2+Ni2+Sn2+Pb2+ | H2 2H+ | CuHgAgPtAu Cu2+Hg22+Ag+Pt2+Au3+ |
| Восстанавливается вода: 2H2O+2ē=H2↑+2OH−; Mn+ не восстанавливается | Восстанавливаются катионы металла и вода: Mn++nē=M0 2H2O+2ē=H2↑+2OH− | Восстанавливаются катионы металла: Mn++nē=M0 | |
| nē→ | |||
2. Процесс на анодезависит от материала анода и от природы аниона.
Анодные процессы
| Кислотный остаток Асm– | Анод | |
| Растворимый | Нерастворимый | |
| Бескислородный | Окисление металла анода | Окисление аниона (кроме F–) Acm−−mē=Ac0 |
| Кислородсодержащий | В кислотной и нейтральной средах: 2H2O−4ē=O2↑+4H+ В щелочной среде: 4OH−−4ē=O2↑+4H+ | |
2.1. Если анод растворяется (железо, цинк, медь, серебро и все металлы, которые окисляются в процессе электролиза), то окисляется металл анода, несмотря на природу аниона.
2.2. Если анод не растворяется (его называют инертным — графит, золото, платина), то:
а) при электролизе растворов солей бескислородных кислот (кроме фторидов) на аноде идет процесс окисления аниона;
б) при электролизе растворов солей кислородсодержащих кислот и фторидов на аноде идет процесс окисления воды (выделяется О2↑). Анионы не окисляются, они остаются в растворе;
в) анионы по их способности окисляться располагаются в следующем порядке:

Попробуем применить эти правила в конкретных ситуациях.
Рассмотрим электролиз раствора хлорида натрия в случае, если анод нерастворимый и если анод растворимый.
1) Анод нерастворимый (например, графитовый).
В растворе идет процесс электролитической диссоциации:
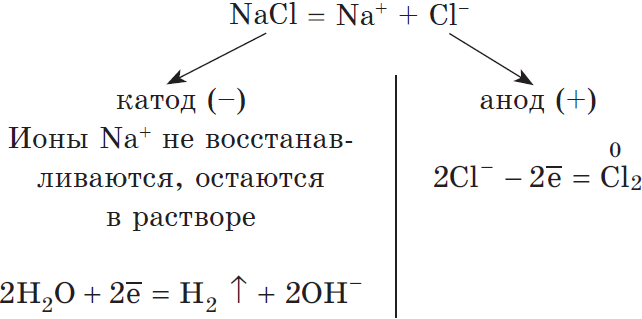
Суммарное уравнение:
2H2O+2Cl−=H2↑+Cl2↑+2OH−.
Учитывая присутствие ионов Na+ в растворе, составляем молекулярное уравнение:
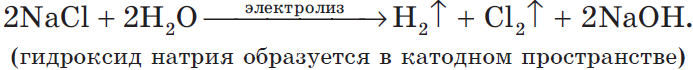
2) Анод растворимый (например, медный):
NaCl=Na++Cl−.
Если анод растворимый, то металл анода будет окисляться:
Cu0−2ē=Cu2+.
Катионы Cu2+ в ряду напряжений стоят после (Н+), по этому они и будут восстанавливаться на катоде.
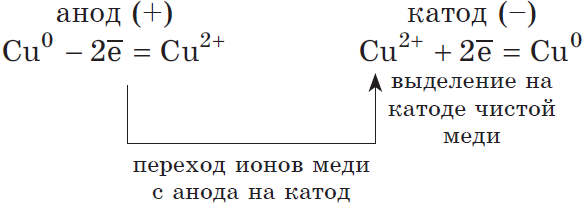
Концентрация NaCl в растворе не меняется.
Рассмотрим электролиз раствора сульфата меди (II) на нерастворимом аноде:
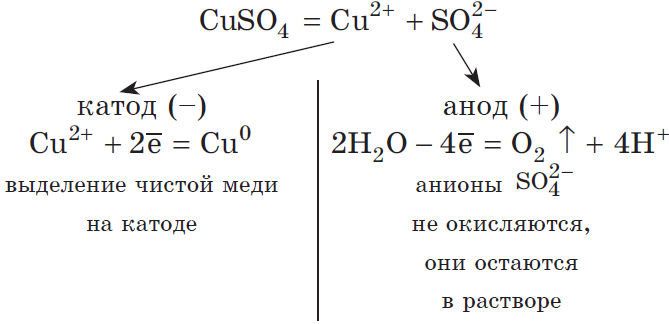
Cu2++2ē=Cu0|2
2H2O−4ē=O2↑+4H+|1
Суммарное ионное уравнение:
2Cu2++2H2O=2Cu0+O2↑+4H+
Суммарное молекулярное уравнение с учетом присутствия анионов SO42− в растворе:
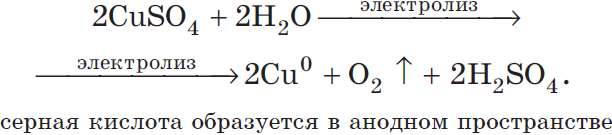
Электролиз расплавов и растворов веществ широко используется в промышленности:
- Для получения металлов (алюминий, магний, натрий, кадмий получают только электролизом).
- Для получения водорода, галогенов, щелочей.
- Для очистки металлов — рафинирования (очистку меди, никеля, свинца проводят электрохимическим методом).
- Для защиты металлов от коррозии (хрома, никеля, меди, серебра, золота) — гальваностегия.
- Для получения металлических копий, пластинок — гальванопластика.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|