
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Аммиак и амины- слабые ОСНОВАНИЯ.
Виды изомерии аминов:

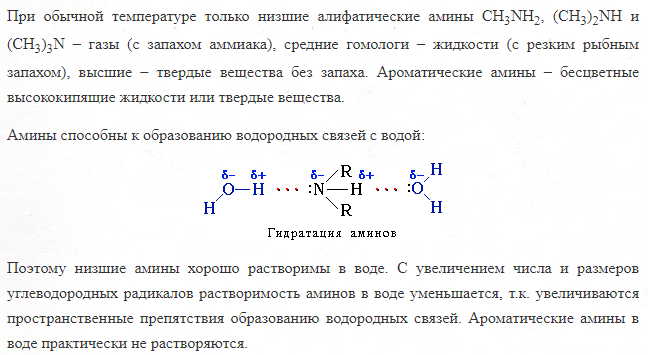
Физические свойства аминов: 
Химические свойства аминов:
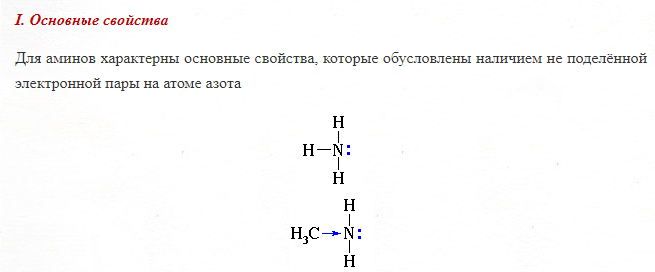
Благодаря неподеленной электронной паре атома азота, аммиак и амины способны присоединять положительно заряженный атом водорода, образующийся при диссоциации кислот. Кислоты диссоциируют на ион водорода, следовательно, вещества, которые его присоединяют обладают ровно противоположными свойствами- ОСНОВНЫМИ.
Аммиак и амины- слабые ОСНОВАНИЯ.
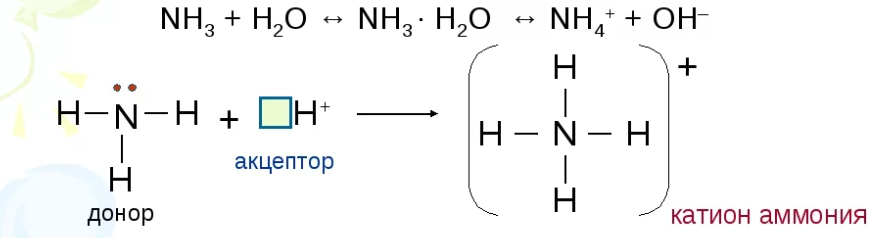
1. Взаимодействие с водой:
В одном объеме воды растворяется 700 объемов аммиака (при н.у.). Такая растворимость объясняется не просто тем, что аммиак растворяется в воде, но и взаимодействует с ней:


2. Взаимодействие с кислотами:

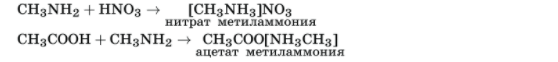

Более сильные основания (щелочи) вытесняют аммиак из его солей:
NH4Cl + KOH = NH3 + KCl + H2O;
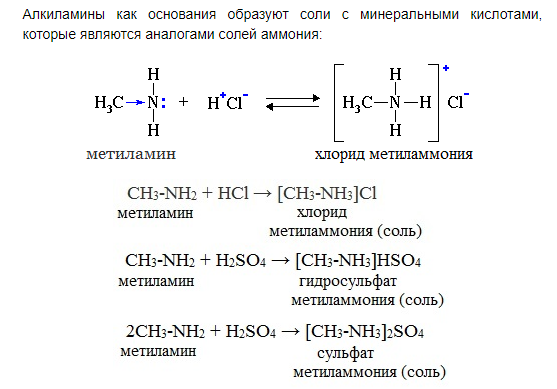
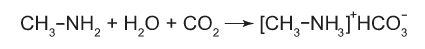

Алифатические амины – более сильные основания, чем аммиак, т.к. алкильные радикалы увеличивают электронную плотность на атоме азота. По этой причине электронная пара атома азота удерживается менее прочно и легче взаимодействует с протоном.
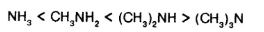
2. Окисление (горение)

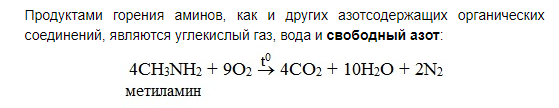
СnН2n+3N+ (1,5n+0,75) O2→ n CО2 +0,5 N2 +(n+1,5) Н2О
Специфические свойства аминов:
1. Качественная реакция- взаимодействие с азотистой кислотой: НNО2:
Первичные амины при взаимодействии с азотистой кислотой образуют азот и спирт:


Вторичные амины дают маслянистые жидкости, называемые N- нитрозоаминами:
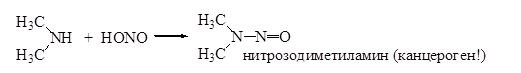
Третичные амины в такие реакции не вступают 
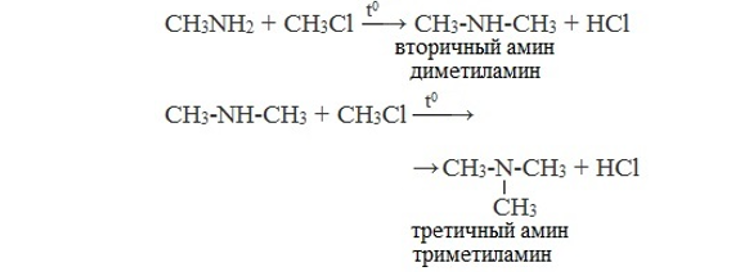
2.Алкилирование аминов- реакция ГОФМАНА:
В результате этой реакции первичные амины превращаются во вторичные, вторичные- в третичные:
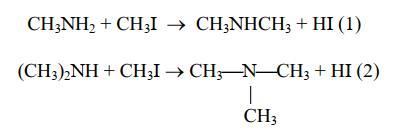
Но так как у атома азота есть неподеленная электронная пара, то вторичный амин немедленно реагирует с иодоводородом (третичный амин практически не реагирует с иодоводородом), поэтому реакцию ведут в присутствии щелочи, которая связывает выделяющийся ( в данном случае) иодоводород:
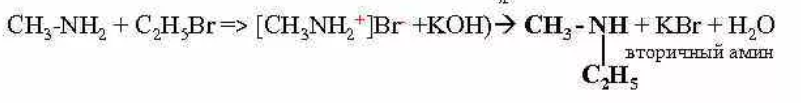
3. Ацилирование аминов- взаимодействие с карбоновыми кислотами, ангидридами карбоновых кислот, хлорангидридами карбоновых кислот. Образуются АМИДЫ:
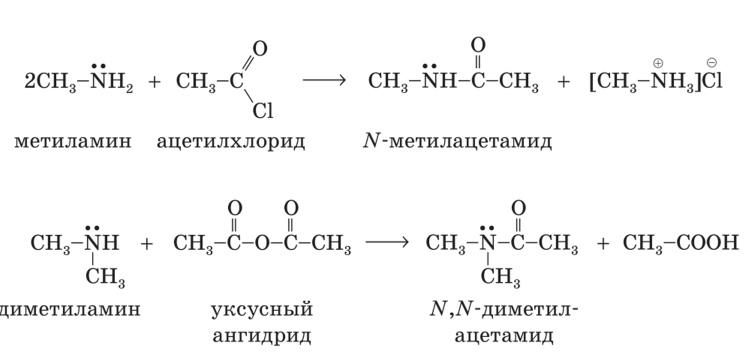
Третичные амины в такие реакции не вступают, так как не содержат атомы водорода в аминогруппе.
4. Взаимодействие с альдегидами и кетонами: 
Способы получения:
1. Восстановление нитросоединений: 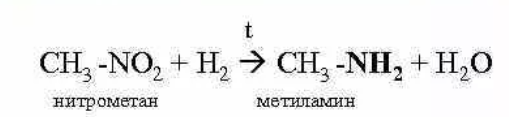
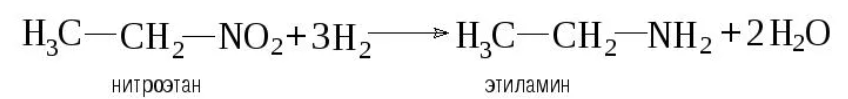
!!! Никогда не получится амин, если в левой части есть кислота- идет СОЛЕОБРАЗОВАНИЕ!
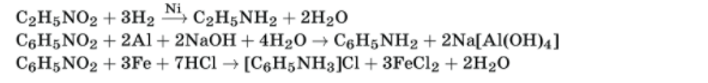



|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|