
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Теория по теме. Модели атомов. Постулаты Бора. Энергетические уровни атома водорода». Все видео смотреть обязательно!!!. Модели атомов. Строение атома.. Постулаты Бора
Теория по теме
«Модели атомов. Постулаты Бора. Энергетические уровни атома водорода»
Все видео смотреть обязательно!!!
https://www.youtube.com/watch?v=zcOpOB3kujw&ab_channel=%D0%A8%D0%9A%D0%9E%D0%9B%D0%90%D0%9E%D0%9D%D0%9B%D0%90%D0%99%D0%9D
модель атома Томпсона и Резерфорда 2.47
https://www.youtube.com/watch?v=1RCVlRMm1e8&ab_channel=%D0%98%D0%9D%D0%A4%D0%9E%D0%A3%D0%A0%D0%9E%D0%9A
постулаты Бора 5.23
https://www.youtube.com/watch?v=Bmwc3B-iIr4&ab_channel=KhanAcademyRussian
!!! энергетические уровни атома водорода 11.08
Модели атомов. Строение атома.



Данный вывод противоречит тому, что атом – устойчивое образование и волновая теория не смогла разрешить это противоречие.
Постулаты Бора
Первый постулат Бора (постулат стационарных состояний):
Атомная система может находиться только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает.
Второй постулат Бора (правило частот) формулируется следующим образом:
При переходе атома из одного стационарного состояния с энергией En в другое стационарное состояние с энергией Em излучается или поглощается квант, энергия которого равна разности энергий стационарных состояний:
|
где h – постоянная Планка. Отсюда можно выразить частоту излучения:
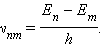
| 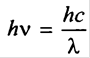
|
Если атом поглощает фотон, то это означает, что электрон в атоме получает энергию, а, значит, может перейти на более высокий энергетический уровень.
Если атом излучает энергию, то это означает, что электрон в атоме теряет энергию, а, значит, переходит на более низкий энергетический уровень.
Пример:
На рисунке изображена упрощённая диаграмма нижних энергетических уровней атома. Нумерованными стрелками отмечены некоторые возможные переходы атома между этими уровнями. Горизонтальными прямыми отмечены разрешенные значения энергии, расстояния между которыми пропорциональны частоте кванта энергии.
Поглощению света соответствует переход вверх, меньшей частоте соответствует меньшая стрелка. ( 3)
Излучению света соответствует переход вниз, большей частоте соответствует бо́льшая стрелка. ( 2)
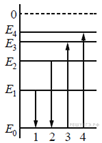
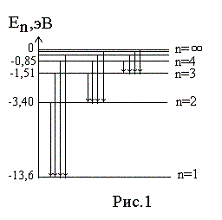
Н. Бор применил постулаты для построения теории простейшей атомной системы — атома водорода и рассчитал дискретные (прерывные) значения энергий стационарных состояний атома (энергетические уровни), которые условно изобразил в виде горизонтальных прямых. Число n соответствует энергетическому уровню.
Энергетическая диаграмма состояний атома водорода
 ∞
∞
Энергия основного состояния (наиболее устойчивого) (n = 1), равна E1= - 13,6 эВ. На рис. 1 приведена диаграмма энергетических уровней электрона в атоме водорода, на которой горизонтальными прямыми отмечены разрешенные значения энергии. При увеличении числа n энергетические уровни сближаются все больше и больше и соответствуют тому, что электрон при n= ∞ становится свободным (не связанным с ядром), а атом при этом ионизируется. Энергия электрона в атоме (потенциальная энергия взаимодействия с ядром атома) отрицательна.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|