
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Глава 4. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Глава 4. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
4.1 Теоретическая часть
Окислительно-восстановительные реакции (ОВР) – это реакции, при протекании которых происходит изменение степени окисления химических элементов, входящих в состав реагентов.
Степень окисления – условный (формальный) заряд атома в химическом соединении, который находят, считая химические связи в соединении чисто ионными.
| Окисление потеря электронов, т.е. повышение степени окисления. Окислитель присоединяет электроны, сам восстанавливается, понижает свою степень окисления | Восстановление приобретение электронов, т.е. понижение степени окисления. Восстановитель отдает электроны, сам окисляется, повышает свою степень окисления |
| Число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем | |
Окислителями являются вещества, содержащие элемент, который может приобретать более низкую степень окисления, чем в данном веществе. Например, Fe+3 является окислителем в составе FeCl3, так как существует Fe+2 в составе FeCl2.
Восстановителями являются вещества, содержащие элемент, который может проявлять более высокую степень окисления. Например, Fe+2 в составе FeCl2 является восстановителем, так как существует Fe+3 в составе FeCl3.
В промежуточной степени окисления элемент может выступать как в роли окислителя, так и восстановителя. Например, сера (IV) в составе SO2 – окислитель, так как существует сера S (0) в простом веществе, и, в других обстоятельствах – окислитель, так как существует S (VI) в составе SO3.
Для составления уравнений окислительно-восстановительных реакций используют два метода подбора коэффициентов: электронного баланса и электронно-ионного баланса.
Для реакций, протекающих в водном растворе, предпочтителен метод электронно-ионного баланса. Этим методом составляются уравнения реакций окисления и восстановления реально существующих в растворе ионов (например, MnO42–, SO42–, Cr2O72–) и молекул (например, H2S, SO2, H2O2).
Молекулы растворителя (вода) или ионы среды (H+, OH–) также могут участвовать в процессе окисления-восстановления.
Среда должна учитываться при составлении уравнений ОВР в соответствии со следующими правилами:
1. В кислой среде при составлении уравнений полуреакций можно использовать ионы H+ и молекулы H2O
2. В щелочной - молекулы H2O и ион OH–
3. В нейтральной среде в левой части уравнения полуреакции пишут только молекулы воды, а в правой как ионы H+, так и OH–.
Окислительную способность веществ характеризует окислительно-восстановительный потенциал E. В справочниках приведены стандартные окислительно-восстановительные потенциалы Eo, измеренные относительно обратимого водородного электрода.
В любой окислительно-восстановительной реакции как в исходных веществах, так и в продуктах реакции, имеются сопряженные пары окислитель-восстановитель. Направление окислительно-восстановительной реакции обусловливает тот окислитель, у которого значение электродного потенциала больше.
Например, в смеси веществ: K2Cr2O7, HCl, CrCl3, Cl2 (4.1) окислителями являются K2Cr2O7 и Cl2. Их стандартные окислительно-восстановительные потенциалы соответственно равны:.
Cr2O7 2– + 14H+ +6e = 2Cr 3+ + 7H2O Eo= +1,33 (4.2)
Cl2 +2e = 2Cl– Eo = +1,36 (4.3)
У хлора стандартный электродный потенциал выше, следовательно в стандартных условиях он является более сильным окислителем, чем дихромат калия. Соответственно в смеси веществ (4.1) при стандартных условиях должна идти реакция:
2CrCl3 + 3Cl2 + 7H2O = K2Cr2O7 + 14HCl (4.4)
Уравнения (4.2) и (4.3) называют уравнениями полуреакций.
Если разность стандартных восстановительных потенциалов невелика ( не более 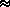 0.3В), направление окислительно-восстановительной реакции можно изменить, изменяя концентрации веществ и температуру.
0.3В), направление окислительно-восстановительной реакции можно изменить, изменяя концентрации веществ и температуру.
При изменении концентрации и температуры величина окислительно-восстановительного потенциала определяется уравнением Нернста
E=Eo + 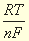 ln
ln 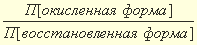 (4.5)
(4.5)
где R – газовая постоянная, 8,314 Дж/моль.К, Т – температура, К, n– число электронов, принимающих участие в полуреакции
Например, для полуреакции (4.2) для стандартной температуры 298К и с переходом от натурального логарифма к десятичному уравнение Нернста будет иметь вид
E=1,33 + (0,059/6) lg 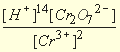
Окислительно-восстановительные реакции протекают самопроизвольно, если разность стандартных электродных потенциалов окислителя и восстановителя, или э.д.с. окислительно-восстановительной реакции 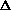 E > 0.
E > 0.
По известному значению 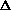 Eo можно вычислить
Eo можно вычислить 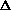 rGo и константу равновесия К окислительно-восстановительной реакции
rGo и константу равновесия К окислительно-восстановительной реакции
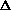 rGo= –mF
rGo= –mF 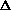 Eo = –RTlnKp
Eo = –RTlnKp
где m – наименьшее общее кратное числа отданных и принятых в реакции электронов.
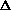 E = (RT/mF) lnKр (4.7)
E = (RT/mF) lnKр (4.7)
На окислительную способность реагентов влияет pН среды.
Особенно наглядно это видно на примере окислительных свойств перманганат-иона.
Кислая среда
| MnO4– + 8H+ +5e |  Mn2+ +4H2O Mn2+ +4H2O
| (бесцветный или слабо розовый) |
| Eo = + 1,51 В | ||
| MnO4– + 4H+ +3e |  MnO2 + 2H2O MnO2 + 2H2O
| (бурый раствор или осадок) |
| Eo = + 1,69 В |
Нейтральная среда
| MnO4– + 2H2O + 3e |  MnO2 + 4OH– MnO2 + 4OH–
| ( бурый раствор или осадок) |
| Eo = + 0,60 В |
Щелочная среда
| MnO4– + е |  MnO4 2– MnO4 2–
| (зеленый раствор) |
| Eo = + 0,56В |
Манганат ион MnO4 2– неустойчив и легко диспропорционирует
3MnO4 2– +2H2O + 2e  2MnO4– + MnO2 + 4OH–
2MnO4– + MnO2 + 4OH–
Для соединений хрома (VI) среда мало влияет на степень окисления продуктов, но вследствие амфотерности гидроксида хрома (III) оказывает влияние на их состав
Кислотная среда Cr2O7 2– + 6e + 14H+  2Cr 3++ 7H2O
2Cr 3++ 7H2O
Щелочная среда CrO4 2– + 3e +4H2O–  Cr(OH)4– + 4OH–
Cr(OH)4– + 4OH–
Окислительные свойства галогенов ослабевают в ряду F2> Cl2> Br2> I2
| F2 + 2e = 2F– | Eo = + 2,87В |
| Cl2 + 2e=2Cl– | Eo= +1,36В |
| Br2+ 2e= 2Br– | Eo= + 1,06В |
| I2 +2e = 2I– | Eo= + 0,54В |
Наглядно это проявляется в реакции кристаллических солей галогенидов с концентрированной серной кислотой.
KCl + H2SO4 = KHSO4 + HCl
8KI + 9H2SO4 = 4I2 +H2S +4H2O+8KHSO4
В случае бромида идут обе реакции.
Убедиться в образовании галогенов можно по окраске бензольного слоя.
Пероксид водорода H2O2 проявляет как окислительные, так и восстановительные свойства. В зависимости от среды ОВР с его участием можно представить в виде следующих полуреакций
| Окислитель: | H2O2 +2H+ +2e = 2H2O | Еo=+1,77 |
| H2O2 +2e = 2OH– | Eo= 0,94 | |
| Восстановитель | H2O2 –2e = O2 + 2H+ | Eo=–0,68 |
| H2O2 + 2OH– –2e = O2 + 2H2O | Eo= +0,15 |
Например, пероксид водорода в щелочной среде окисляет Cr(III) до Cr(VI)
2[Cr(OH)4]– +3H2O2 +2OH– = 2CrO4 2– +8H2O и образуется желтый раствор хромата.
В сильно кислой среде под действием дихромата идет окисление пероксида водорода.
K2Cr2O7 + 4H2SO4 + 3H2O2 = 3O2 + Cr2(SO4)3 + K2SO4 +7H2O
В некоторых случаях, действие пероксида водорода на дихромат приводит к образованию различных пероксокомплексов, устойчивых только в органической фазе.
Например, в кислой среде образуются голубого цвета соединения состава
H2Cr2O7 + 4H2O2 =2CrO(O2)2H2O + 3H2O
Образующееся перекисное соединение экстрагируется в органический слой, окрашивая его в синий цвет. Эту реакцию используют в аналитической химии для обнаружения хрома (VI)
4.1.1.Вопросы по теме
1. Что такое окислитель, восстановитель, степень окисления?
2. Могут ли данные вещества проявлять в реакциях свойства окислителя: Mg, HNO2, HClO, S, Cr2O3 , KOH? Приведите примеры реакций, подтверждающих Ваш ответ.
3. Приведите 3 примера веществ, проявляющих как свойства окислителя, так и восстановителя.
4. Можно ли окислить ионы Fe2+ хлором в стандартные условиях? В обосновании ответа приведите стандартные потенциалы полуреакций.
5. Можно ли окислить ионы Fe2+ иодом в стандартных условиях? В обосновании ответа приведите стандартные потенциалы полуреакций.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|