- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тема: Массовая доля растворенного вещества. Расчетная задача № 4. Определение массовой доли растворенного вещества.
Химия
8 класс
Тема: Массовая доля растворенного вещества. Расчетная задача № 4. Определение массовой доли растворенного вещества.
Поскольку данный материал у вас в учебнике отсутствует, его необходимо законспектировать у себя в тетради, все задачи, как образцы должны быть переписаны, также как правила и формулы.
Существуют различные способы выражения концентрации растворённого вещества в растворе, мы познакомимся с массовой долей растворённого вещества (процентной концентрацией).
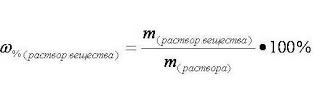
I. Массовая доля растворённого вещества wрастворённого вещества- это безразмерная величина, равная отношению массы растворённого вещества mрастворённого вещества к общей массе раствора mраствора :
mраствора = mрастворённого вещества + mрастворителя
Массовую долю растворённого вещества(процентная концентрация) обычно выражают в долях единицы или в процентах. Например, массовая доля растворённого вещества – CaCl2 в воде равна 0,06 или 6%. Это означает, что в растворе хлорида кальция массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г.
ЗАПОМНИТЕ!

Пример решения задачи:
Сколько грамм соли и воды нужно для приготовления 300 г 5% раствора?
Решение:
| Дано: m раствора = 300 г wрастворённого вещества = 5% | Решение: 1. Запишем формулу для расчёта массовой доли:
2. Преобразуем формулу и вычислим массу растворённого вещества в растворе m растворённого вещества = (wрастворённого вещества · m раствора) / 100% m растворённого вещества = (5 % · 300 г) / 100% = 15 г 3. Вычислим массу растворителя – воды: |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|