
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Систематический анализ
Систематический анализ
Систематический ход анализа— определенная последовательность выполнения аналитических реакций, при которой каждый ион обнаруживают после того, как будут обнаружены и удалены мешающие ионы.
Допустим, что раствор нужно испытать на присутствие катиона Са2+, но в нем одновременно может содержаться и ион Ва2+. Катион Са2+ принято определять в виде оксалата:
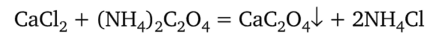
Эта реакция достаточно чувствительна, но не специфична, так как оксалат аммония дает белый кристаллический осадок не только с Са2+, но также с Ва2+ и другими ионами. Поэтому, прежде чем обнаруживать катион Са2+, необходимо проверить, присутствует ли в растворе мешающий ион Ва2+. Последний можно обнаружить в отдельной порции раствора, действуя дихроматом калия, с которым Ва2+ дает характерный желтый осадок:
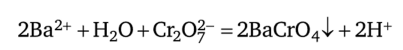
Присутствие иона Са2+ не мешает обнаружению иона Ва2+ этой реакцией, так как хромат кальция СаСг04 хорошо растворим в воде (выпадает в осадок только из концентрированных растворов солей кальция). Дальнейший ход анализа зависит от результата проведенного испытания. Если окажется, что ион Ва2+ отсутствует, то в другой порции раствора можно обнаружить катион Са2+, действуя оксалатом аммония. Если же катион Ва2+ присутствует, то, прежде чем определять Са2+, следует полностью удалить из раствора ионы Ва2+. Для этого на весь раствор действуют избытком дихромата калия, убеждаются, что ионы Ва2+ полностью осаждены в виде хромата бария, и, отделив осадок, обнаруживают катионы Са2+.
Следовательно, в систематическом ходе анализа применяют не только реакции обнаружения отдельных ионов, но также и реакции отделения их друг от друга. Разделение ионов чаще всего основывается на различной растворимости аналогичных солей (например, ВаСг04 и СаСг04). Иногда в этих целях используют и различную летучесть соединений. Так, отделяют катионы NH4+ от ионов Na+, К+, Mg2+ выпариванием раствора и прокаливанием сухого остатка. При этом соли аммония разлагаются, улетучиваются, а соединения Na+, К+ и Mg2+ остаются. Отделяя один ион от другого, нужно внимательно следить за полнотой разделения, без которой результаты будут ошибочными. Например, при неполном удалении иона NH4+ можно в дальнейшем «переоткрыть» К+ и Na+, так как с реактивами на эти катионы взаимодействует и ион аммония. Полноту удаления мешающего иона проверяют в каждом случае специальной пробой.
Систематический анализ не следует противопоставлять дробному: эти методы взаимно дополняют друг друга. Каждый из них имеет свою область применения. В ходе систематического анализа ионы выделяют из сложной смеси не по одному, а группами, пользуясь одинаковым отношением их к некоторым реактивам. Например, катионы Ag+, Pb2+ и Hg2+ образуют с анионами СИ малорастворимые хлориды AgCl, РЬС12 и Hg2Cl2, тогда как хлориды всех других распространенных катионов хорошо растворимы в воде. Поэтому, действуя на анализируемый раствор анионом Сl-_ в виде хлороводородной кислоты, можно осадить Ag+, Pb2+, Hg2+ и таким образом отделить их от всех остальных катионов. Иногда действие группового реагента состоит не в осаждении, а, наоборот, в растворении каких-нибудь составных частей осадка. При этом некоторые катионы переходят в раствор. Так, если в осадке одновременно находятся сульфиды многих катионов, то, действуя сульфидом натрия, можно перевести в раствор только ртуть(II), мышьяк, сурьму и олово. В данном случае Na2S также является групповым реагентом.
Удобство применения групповых реагентов заключается в том, что они позволяют сложную аналитическую задачу разделить на несколько более простых. Кроме того, если групповой реагент не дает осадка с исследуемым раствором, то это указывает на отсутствие целой группы катионов. При систематическом анализе последовательность выделения аналитических групп из раствора обратна их нумерации. Первыми выделяют катионы четвертой и пятой групп, катионы же первой группы анализируют в последнюю очередь.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|