
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Реакция Гриньяра
Циклические кислоты растений
Эта группа органических кислот чрезвычайно разнообразна и встречается во многих растений в виде свободных соединений, а чаще производных, участвующих в образовании более сложных органических соединений – терпенов, алкалоидов, растительных фенолов и др.
Ароматические кислоты – это производные бензола, в ядре которого карбоксильная группа замещает атом водорода.
Бензойная кислота – простейшая одноосновная карбоновая кислота ароматического ряда.
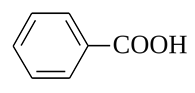
Впервые выделена возгонкой в 16 веке из бензойной смолы (росного ладана), отсюда и получила своё название. Этот процесс был описан у Нострадамуса (1556), а затем у Жироламо Рушелли (1560, под псевдонимом Alexius Pedemontanus) и у Блеза де Виженера (1596).
В 1832 году немецкий химик Юстус фон Либих определил структуру бензойной кислоты. Он также исследовал, как она связана с гиппуровой кислотой.
В 1875 немецкий физиолог Эрнст Леопольд Зальковский исследовал противогрибковые свойства бензойной кислоты, которая долгое время использовалась в консервировании фруктов.
Бензойная кислота — белые кристаллы, плохо растворимые в воде, хорошо — в этаноле, хлороформе и диэтиловом эфире. Бензойная кислота является, подобно большинству других органических кислот, слабой кислотой (pKa 4,21).
Чистая кислота имеет температуру плавления 122,4 °C, температуру кипения 249 °C.
Легко возгоняется; перегоняется с водяным паром, поэтому неэффективно повышать концентрацию водных растворов бензойной кислоты упариванием раствора.
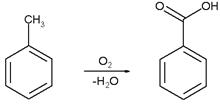
Бензойную кислоту можно получить окислением толуола сильными окислителями, такими, например, как перманганат калия, оксид хрома (VI), азотная или хромовая кислота, а также декарбоксилированием фталевой кислоты.
В промышленных масштабах бензойную кислоту получают окислением толуола кислородом на катализаторе (нафтената марганца или кобальта).
В свободном виде обнаружена в ягодах брусники, но особенно часто встречается в составе гликозидов, эфирных масел и бальзамов. Многие фенольные кислоты можно представить в виде производных бензойной кислоты.
Химические свойства.
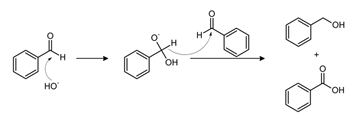
Реакция Канниццаро
Бензальдегид в основной среде претерпевает преобразование по реакции Канниццаро. В итоге получается бензойная кислота и бензиловый спирт.
Реакция Гриньяра
Из бромбензола по реакции карбоксилирования фенилмагнийбромида
С6Н5MgBr+CO2→ C6H5COOMgBr; С6H5COOMgBr+HCl→C6H5COOH+MgBrCl
Фенолкарбоновые кислоты широко распространены среди растительного царства, а протокатеховая кислота в свободном виде найдена в плодах аниса звездчатого, а так же в чешуе лука. Это вещество обеспечивает устойчивость растений к грибам и микроорганизмам.
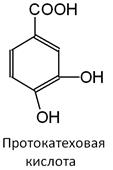
Протокате́ховая кислота (3,4-дигидроксибензойная кислота, 3,4-диоксибензойная кислота, протокатехиновая кислота, сокр. англ. PCA, 3,4-DHB, 3,4-DHBA) — органическое соединение, фенолокислота, один из шести изомеров дигидроксибензойной кислоты. Протокатеховая кислота — один из простейших представителей так называемых полифенолов и обладает антиоксидантными свойствами. Имеет значительное распространение в природе.
Впервые получена Гессе в 1859 году окислением хинной кислоты бромной водой. Название «протокатеховая кислота» было дано веществу, полученному Штреккером в 1861 году при сплавлении пипериновой кислоты с едким кали. В 1863 году Глазивец показал тождественность «карбогидрохиноновой кислоты» Гессе и «протокатеховой кислоты» Штреккера.
Образуется спонтанной или ферментативной дегидратацией дегидрошикимовой кислоты. Может также возникать в результате ферментативного гидроксилирования пара-гидроксибензоата и мета-гидроксибензоата, образуется также в процессах биологического окисления и расщепления многих других соединений. У многих микроорганизмов протокатехат выявлен как промежуточный продукт биодеградации различных соединений и подвергается дальнейшему расщеплению до продуктов, которые далее утилизируются через цитратный цикл.
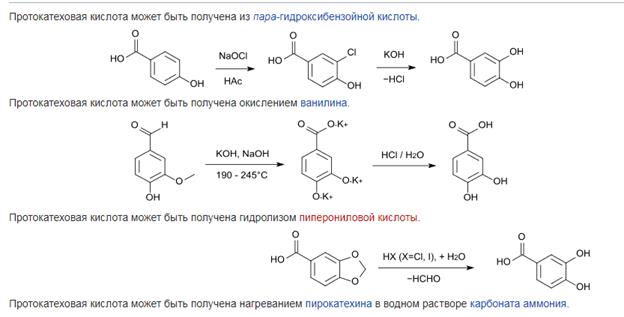
Ванилиновая кислота (4-гидрокси-3-метоксибензойная кислота) — органическая кислота, 3-монометиловый эфир протокатеховой кислоты.
Порошок или мелкие кристаллы белого или светло-жёлтого цвета. Обладают приятным запахом.
Соли ванилиновой кислоты называются ванилатами. Ванилат натрия образуется при добавлении в раствор ванилина в толуоле раствора едкого натра в метиловом спирте. Густой белый осадок отделяется центрифугированием, промывается эфиром и высушивается. Выход ванилата натрия — 74%[1].
Промежуточный продукт биоконверсии феруловой кислоты в ванилин.
Побочный продукт метаболизма кофейной кислоты, обнаруживается в моче людей, употреблявших в пищу сладости с ванилью или шоколад, либо пивших чай, кофе.
Ванилатдеметилаза Acinetobacter и Pseudomonas катализует окисление ванилиновой кислоты до протокатеховой кислоты по схеме
Ванилиновая кислота встрчеается в древесине.
Салици́ловая кислота (от лат. salix «ива», из коры которой она была впервые выделена) — 2-гидроксибензойная или фенольная кислота, С6Н4(ОН)СООН; бесцветные кристаллы, хорошо растворима в этаноле, диэтиловом эфире и других полярных органических растворителях, плохо растворима в воде (1,8 г/л при 20 °C).
Выделена из ивовой коры итальянским химиком Рафаэлем Пириа и затем синтезирована им же.
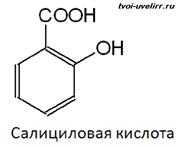
В природе встречается в растениях в виде производных — главным образом в виде гликозида метилового эфира (в частности, салициловая кислота была впервые выделена из коры ивы, откуда и происходит название), свободная салициловая кислота наряду с салициловым альдегидом в небольших количествах содержится в эфирном масле, выделяемых из цветов некоторых видов спиреи (Spiraea ulmaria, Spiraea digitata).
Салициловая кислота легкорастворима в этаноле, диэтиловом эфире, малорастворима в сероуглероде. Растворимость в воде (г/л): 1,2 (0 °C), 1,8 (20 °C), 8,2 (60 °C), 20,5 (80 °C).
Является двухосновной кислотой (очень слабой по второй ступени): pK1 = 2,97 pK2 = 13.82.
Реакционная способность бензольного ядра салициловой кислоты определяется наличием двух заместителей с противоположными мезомерным и индуктивным эффектами: донорной гидроксильной и акцепторной карбоксильной: в результате салициловая кислота значительно легче бензойной, но не так активно, как фенол, вступает в реакции электрофильного замещения вследствие стабилизации промежуточного σ-комплекса гидроксильной группой.
Электрофильное замещение направляется в орто- и пара-положения к гидроксилу и зачастую сопровождается декарбоксилированием: так, нитрование салициловой кислоты приводит к пикриновой кислоте (2,4,6-тринитрофенолу), а бромирование — к 2,4,6-трибромфенолу, хотя сульфирование олеумом идёт без декарбоксилирования и даёт сульфосалициловую (2-гидрокси-5-сульфобензойную) кислоту.
При нагревании салициловая кислота декарбоксилируется до фенола, в промышленности салициловую кислоту обычно получают обратной реакцией — карбоксилированием фенолята натрия углекислым газом при 150—180 °C и давлении 5 атм (реакция Кольбе — Шмитта):
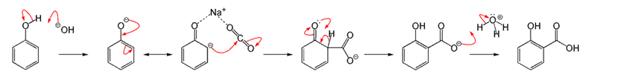
Салициловая кислота содержится, например, в корнях дуба. В настоящее время показано ее регулирующие действие на ряд физиологических и биохимических процессов в растении ( образование этилена, восстановление нитратов)
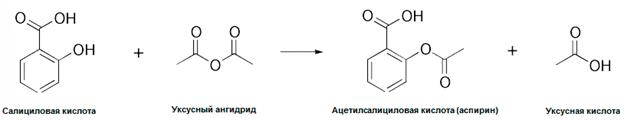
Ацетилсалици́ловая кислота́ (разг. аспири́н; лат. Acidum acetylsalicylicum, салициловый эфир уксусной кислоты) — лекарственное средство, оказывающее анальгезирующее (обезболивающее), жаропонижающее, противовоспалительное действие.
Механизм действия и профиль безопасности ацетилсалициловой кислоты хорошо изучены, её эффективность клинически апробирована, в связи с чем данный препарат входит в список важнейших лекарственных средств Всемирной организации здравоохранения[3], а также в перечень жизненно необходимых и важнейших лекарственных средств Российской Федерации.
Ацетилсалициловую кислоту в лаборатории получают взаимодействием салициловой кислоты и уксусного ангидрида в присутствии серной кислоты.
Для очистки продукт перекристаллизовывают. Выход составляет около 80 %.
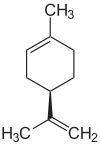
Лимоне́н— 1-метил-4-изопропенилциклогексен-1, углеводород группы терпенов.
Лимонен образуется из геранилфосфата через циклизацию промежуточно образующегося карбокатиона.

D-лимонен ((R)-энантиомер) обладает цитрусовым запахом и используется в качестве отдушки в парфюмерии и в производстве ароматизаторов. Запах L-лимонена ((S)-энантиомер) имеет ярко выраженный запах хвои, этот энантиомер также используется в качестве отдушки. Обсуждаются его возможные канцерогенные свойства.
При нагревании до 300 °C оптически активные формы лимонена рацемизуются в дипентен, при высоких температурах (пропускание паров над раскалённой металлической поверхностью) разлагается с образованием изопрена.
Лимонен окисляется по аллильному положению циклогексенового ядра до карвона, однако в промышленности карвон синтезируют из лимонена нитрозированием нитрозилхлоридом с последующим гидролизом образовавшегося оксима карвона. Дегидрирование лимонена в присутствии серы ведёт к образованию цимола.
Лимонен - важный компонент масла из лимонной корки. Пинен – главная составная часть масла сосны и живицы. Служит исходным соедением для получения синтетических душистых веществ.
Аскорби́новая кислота́ (от др.-греч. ἀ «не-» + лат. scorbutus «цинга», дословно противоскорбутный) — органическое соединение с формулой C6H8O6, является одним из основных веществ в человеческом рационе, которое необходимо для нормального функционирования соединительной и костной ткани. Выполняет биологические функции восстановителя и кофермента некоторых метаболических процессов, является антиоксидантом.
Биологически активен (способен участвовать в биохимических процессах) только один из изомеров — L-аскорбиновая кислота, называемая также витамином C, который в природе содержится во многих фруктах и овощах
По физическим свойствам аскорбиновая кислота представляет собой белый кристаллический порошок кислого вкуса. Легко растворим в воде, растворим в спирте[2]. Температура плавления L-аскорбиновой кислоты — 190—192 °C (с разложением)[4].
Из-за наличия двух асимметрических атомов существуют четыре диастереомера аскорбиновой кислоты. Две условно именуемые L- и D- формы хиральны относительно атома углерода в фурановом кольце, а изо- форма является D-изомером по атому углерода в боковой этиловой цепи.
D-изоаскорбиновая, или эриторбовая (англ.)русск., кислота используется в качестве консерванта — пищевой добавки E315.
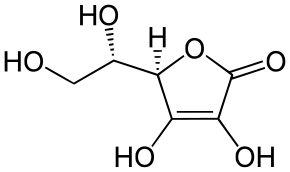
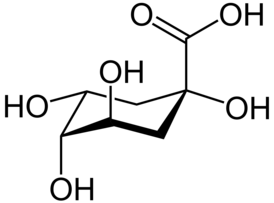
Хинная кислота — одноосновная полигидроксикарбоновая кислота состава C7H12O6. Представляет собой кристаллическое вещество, содержащееся в коре хины, кофейных зёрнах и многих других растениях. Хинную кислоту получают синтетически гидролизом хлорогеновой кислоты.
 Биосинтез
Биосинтез
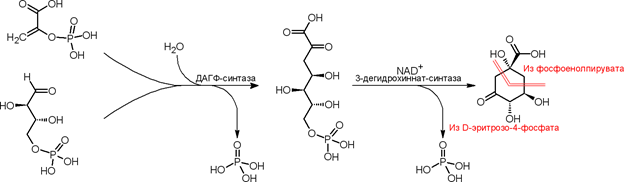
Исходными соединениями для биосинтеза хинной кислоты служат фосфоенолпировиноградная кислота и d-эритрозо-4-фосфат, которые под действием фермента образуют 3-дезокси-d-арабино-гепт-2-улозонат-7-фосфат (ДАГФ), после чего происходит отщепление фосфатного остатка и циклизация в 3-дегидрохинную кислоту, из которой затем получается хинная кислота. Данная схема, являющаяся частью шикиматного пути, доказана для микроорганизмов, однако в высших растениях также были обнаружены ферментные системы, предназначенные для осуществления данной схемы[2].
Хинная кислота была впервые выделена Гофманом в 1790 году из коры хинного дерева. Хинная кислота часто накапливается в растениях в значительных количествах. В частности, из молодых побегов ели удавалось выделить 13,4 % хинной кислоты (в пересчёте на массу сухого сырья)[4]. Также данное соединение обнаружено в табаке, сливах, яблоках, винограде, чернике, клюкве, зёрнах кофе, плодах айвы, яблоках и др.[2]
Был предложен количественный метод выделения хинной кислоты из фруктов, основанный на относительно высокой растворимости её кальциевой и свинцовой солей по сравнению с солями этих металлов и других органических кислот[5].
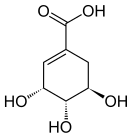
Шики́мовая кислота, по анионной форме известная также как шикима́т — органическая моноциклическая одноосновная мононенасыщенная тригидроксимонокарбоновая кислота. Является интермедиатом в метаболическом пути, получившем название шикиматный путь, благодаря чему является предшественником синтеза таких важнейших соединений, как фенилаланин, тирозин, триптофан, пара-аминобензоат, убихинон.
Хотя шикимовая кислота присутствует у большинства микроорганизмов, растений и грибов, она является лишь промежуточным метаболитом биосинтетических реакций. Поэтому она, не накапливаясь, расходуется на последующие реакции и обнаруживается обычно в очень низких концентрациях. В значительных количествах шикимовая кислота обнаружена только в анисовом бадьяне и родственных растениях.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|