
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Na2CO3 – карбонат натрия. Al2(SO4)3 – сульфат алюминия. Ba(NO3)2 – нитрат бария. CaCl2 – хлорид кальция. K3PO4 – фосфат калия. NaHSO4 – гидросульфат натрия. KHCO3 – гидрокарбонат калия. CaHPO4 – гидрофосфат кальция. CuOH)2CO3 – гидроксокарбонат меди (II).
Na2CO3 – карбонат натрия
Al2(SO4)3 – сульфат алюминия
Ba(NO3)2 – нитрат бария
CaCl2 – хлорид кальция
K3PO4 – фосфат калия
Кислые соли – это продукты неполного замещения атомов водорода в кислоте на металл.


К кислым солям относят такие соли как NaHSO4, KHCO3, CaHPO4. Название этих солей складывается из названий средних солей с прибавлением слова «гидро». Назовём наши соли:
NaHSO4 – гидросульфат натрия
KHCO3 – гидрокарбонат калия
CaHPO4 – гидрофосфат кальция
Основные соли – это продукты неполного замещения гидроксогрупп в основании на кислотный остаток.
К таким солям относится малахит,формула которого(CuOH)2CO3. Как видите, это соль состоит из двух гидроксокатионов CuOH+ и двухзарядного аниона кислотного остатка СО32-. Если подсчитать сумму зарядов ионов, то получается, что эта соль электронейтральна. Названия основных солей складывается из названия средней соли с добавлением слова «гидроксо». Например, назовём соли: (CuOH)2CO3, Mg(OH)Cl.

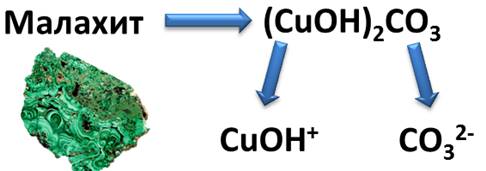
(CuOH)2CO3 – гидроксокарбонат меди (II)
Mg(OH)Cl – гидроксохлорид магния
Соли реагируют с кислотами, но только в том случае, если образуется осадок, или выделяется газ. Этот тип реакций относится к реакциям обмена. Проведём эксперимент. В одну пробирку нальем силиката натрия и серной кислоты, во вторую – карбонат натрия и азотную кислоту, а в третью нитрат натрия и серную кислоту. В результате у нас получается, что в первой пробирке выпал студенистый осадок, во второй пробирке мы можем наблюдать выделение газа, а в третьей изменений нет. Следовательно, химические реакции прошли только в двух пробирках.
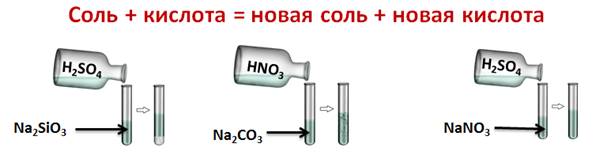
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|