
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Скорость химической реакции. Энергия активации
Скорость химической реакции
Скорость химической реакции- число элементарных актов взаимодействия за единицу времени в единице объема или на единице поверхности; определяется изменением концентрации вещества ко времени:
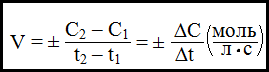
Мгновенная (истинная) скорость выражается производной концентрации данного вещества по времени.
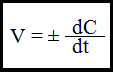
Скорость химической реакции зависит от природы реагирующих веществ, от их концентрации, от температуры, от присутствия катализаторов и ингибиторов и других факторов.
Закон действующих масс:
Скорость химической реакции в каждый момент времени при постоянной температуре в гомогенной среде пропорциональна произведению концентраций реагирующих веществ, возведенных в степени их стехиометрических коэффициентов:

Правило Вант-Гоффа:
Скорость химической реакции при изменении температуры на 10°С увеличивается в два – четыре раза.
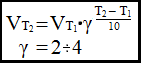
Энергия активации- минимальная энергия, которой должны обладать частицы для осуществления химического взаимодействия.
Энергия активации
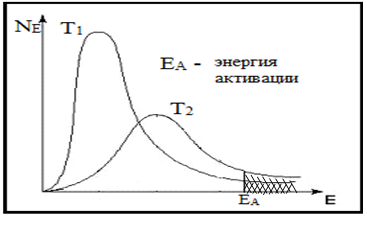
Рис.9 Распределение частиц по энергии
С увеличением температуры доля частиц, обладающих энергией Е ≥ ЕА быстро увеличивается. Распределение частиц по энергиям NE в системе для двух температур T1и Т2 (Т2>T1) показано на рисунке 9. Доля частиц, обладающих энергией Е ≥ ЕА, заштрихована. Увеличение числа частиц с Е ≥ ЕА – главная причина увеличения скорости химической реакции при повышении температуры.
Гомогенные химические реакции- такие реакции, при которых исходные вещества находятся в одном агрегатном состоянии.
 |
N2+ ЗН2 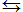 2NH3
2NH3
газ газ газ
Гетерогенные химические реакции- такие реакции, при которых исходные вещества находятся в разных агрегатных состояниях.
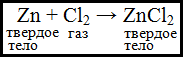
Понятие компонента и фазы
Понятие компонента и фазы можно рассмотреть на конкретном примере:
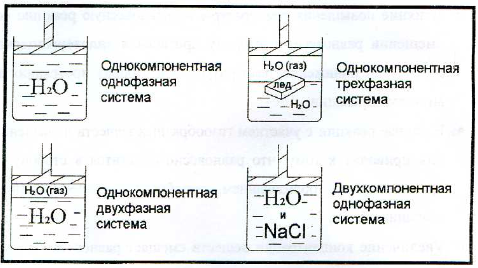
Рис.10. Компоненты и фазы системы
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|