
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Опорный конспект по теме: «Хром и его соединения»
Опорный конспект по теме: «Хром и его соединения»
Cr – d-элемент, его электронная формула 1s22s22p63s23p63d54s1.
Cr0 – как простое вещество – серый, твердый, тугоплавкий, тяжелый металл. На воздухе покрыт тонкой оксидной пленкой, защищающей его от коррозии.
Реагирует с:
1) неметаллами: 2Cr + 3Cl2 → 2CrCl3; 4Cr + 3O2 → 2Cr2O3;
2) с разбавленными кислотами: Cr + 2HCl → CrCl2 + H2; Cr + H2SO4 → CrSO4 + H2;
3) с водяным паром: 2Cr + 3H2O 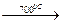 Cr2O3 + 3H2;
Cr2O3 + 3H2;
4) с солями окислителями: 2Cr + KClO3→ Cr2O3 + KCl; 2Cr + 3KClO3 → Cr2O3 + 3KNO2.
Не реагирует с холодной водой, растворами щелочей и аммиака, концентрированной азотной кислотой.
| Cr+2: | CrO | - черный | основные | окислительно-восстановительные свойства |
| Cr(OH)2 | - желтый | |||
| CrCl2 | - в растворе голубые | |||
| CrSO4 |
| CrO | Cr(OH)2 |
| основный: CrO + 2HCl → CrCl2 + H2O | основание: Cr(OH)2 + 2HCl → CrCl2 + 2H2O |
| окислитель-восстановитель: 3CrO→t Cr + Cr2O3 | восстановитель: 4Cr(OH)2+ 2H2O + O2→ 4Cr(OH)3 |
| восстановитель: 4CrO + O2 → 2Cr2O3 |
CrCl2 – соль, диссоциирует CrCl2 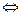 Cr2+ + 2Cl-.
Cr2+ + 2Cl-.
Гидролизуется: Cr2+ + HOH 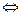 CrOH+ + H+ - среда кислотная; вступает в реакции ионного обмена: Cr2+ + 2OH- → Cr(OH)2; Cr2+ + S2- → CrS↓.
CrOH+ + H+ - среда кислотная; вступает в реакции ионного обмена: Cr2+ + 2OH- → Cr(OH)2; Cr2+ + S2- → CrS↓.
Восстановители: 2CrCl2 +Cl2 → 2CrCl3; CrCl2 + HCl + O2 → CrCl3 + H2O (расставить коэффициенты).
| Cr3+: | Cr2O3 | - зеленый | амфотерные | окислительно-восстановительные свойства
| |
| Cr(OH)3 | - серо-зеленый | комплексообразователи | |||
| Cr2(SO4)3 | - в растворе от зеленого до фиолетового | ||||
| CrCl3 | |||||
| Na3[Cr(OH)6] | - светло-зеленые | ||||
| NaCrO2 |
Сr2O3
Амфотерность: Сr2O3+NaOH 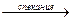 NaCrO2+ H2O; Cr2O3+3H2SO4→t Cr2(SO4)3 + 3H2O.
NaCrO2+ H2O; Cr2O3+3H2SO4→t Cr2(SO4)3 + 3H2O.
Окислитель: Cr2O3 + 2Al →t Al2O3 + 2Cr.
Восстановитель: Cr2O3 + KClO3 + K2CO3 →t K2CrO4 + KCl + CO2 (расставить коэффициенты).
Cr(OH)3
Амфотерность: Cr(OH)3 + 3HCl → CrCl3 + 3H2O.
Комплексообразование: Cr(OH)3 + 3NaOH → Na3[Cr(OH)6].
Нерастворимый гидроксид: 2Cr(OH)3 →t Cr2O3 + 3H2O.
Восстановитель: 2Cr(OH)3 + 4KOH + 3H2O2 → 2K2CrO4 + 8H2O.
Соли диссоциируют: CrCl3 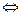 Cr3+ + 3Cl-;
Cr3+ + 3Cl-;
- гидролизуются: Cr3+ + HOH 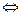 CrOH2+ + H+ (среда кислотная);
CrOH2+ + H+ (среда кислотная);
- гидратируются: CrCl3 + 6H2O → [Cr(H2O)6]Cl3 (комплексообразование);
- вступают в реакции ионного обмена: Cr3+ + 3OH- → Cr(OH)3↓; Cr3+ + РО43- → CrРО4↓;
- окислители: 2CrCl3 + Cr → 3CrCl2; CrCl3 + Al → AlCl3 + Cr;
- восстановители: CrCl3 + NaOH + Cl2 → Na2CrO4 + NaCl + H2O;
CrCl3 + HClO3 + H2O → H2Cr2O7 + HCl (расставить коэффициенты).
NaCrO2 – хромит натрия.
Реагирует с кислотами: NaCrO2 + 4HCl → NaCl + CrCl3 + 2H2O;
с водой: NaCrO2 + 2H2O → NaOH + Cr(OH)3↓;
восстановитель: 2NaCrO2 + 3Cl2 + 8NaOH → 2NaCrO4 + 6NaCl + 4H2O.
Na3[Cr(OH)6] – гексагидроксохромат (III) натрия.
Разлагается при нагревании: Na3[Cr(OH)6]→t NaCrO2 + 2NaOH + 2H2O;
Na3[Cr(OH)6]→t NaOH + Cr(OH)3↓;
разрушается кислотами и кислотными оксидами:
К3[Cr(OH)6] +3HCl(недостаток)→3KCl+Cr(OH)3↓+3H2O;
К3[Cr(OH)6] +3HCl(избыток)→3KCl + CrСl3 + 6H2O;
2К3[Cr(OH)6] + 3CO2 → 3K2CO3 + 2Cr(OH)3↓ + 3H2O;
окисляется: 2К3[Cr(OH)6] + 3KClO3 → 2KCrO4 + KCl + 2KOH + 5H2O.
| Cr+6: | CrO3 | - красный | кислотные | окислители |
| H2CrO4 | - желтый | |||
| H2Cr2O7 | - оранжевый | |||
| K2CrO4 | - желтый | |||
| K2Cr2O7 | - оранжевый |
СrO3
Кислотные: CrO3 + H2O → H2CrO4; CrO3 + 2NaOH → Na2CrO4 + H2O.
Окислитель: 2CrO3 + 3H2S → 2Cr(OH)3↓ + 3S↓.
H2CrO4 –хромовая, H2Cr2O7 – дихромовая кислоты.
H2CrO4 +СrO3 → H2Cr2O7; H2Cr2O7 + H2O → 2H2CrO4;
H2CrO4 + 2NaOH → Na2CrO4 + 2H2O; H2Cr2O7 + 2NaOH → Na2Cr2O7 + 2H2O.
K2CrO4 – хромат; K2Cr2O7 – дихромат.
Хроматы устойчивы в щелочной среде, дихроматы – в кислой:
2CrO42- + 2H+ → Cr2O72- + H2O; Cr2O72- + 2OH- → 2CrO24- + H2O – переход хроматов в дихроматы и наоборот в зависимости от среды.
Соли вступают в реакции ионного обмена:
CrO42- + 2Ag+ → Ag2CrO2↓; Cr2O72- + 2Ag+ → Ag2Cr2O7↓;
являются окислителями: K2Cr2O7 + C →t K2CO3 + Cr2O3 + CO;
K2Cr2O7 + Al →t Cr + KAlO2 + Al2O3;
K2Cr2O7 + C12H22O11 →t K2CO3 + Cr2O3 + CO2 + H2O;
K2CrO4 + H2O + H2S →t Cr(OH)3↓ + S↓ + KOH.
Расставить коэффициенты.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|