
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Лабораторная диагностика туберкулеза
Лабораторная диагностика туберкулеза
Задания для выполнения лабораторной работы
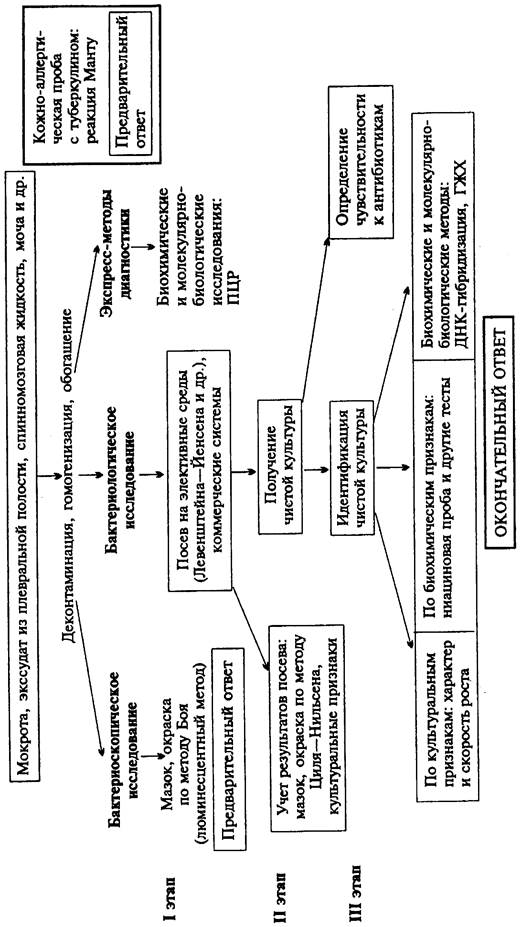
1. Указать материал, подлежащий исследованию;
2. Бактериоскопический метод: окрасить по методу Циля-Нильсена приготовленные из мокроты мазки и провести микроскопическое исследование. Сделать заключение и наметить ход дальнейшего исследования для подтверждения бактериоскопического диагноза;
3. Бактериологический метод:
а) отметить характер роста исследуемой культуры на среде Левенштейна-Йенсена,
б) отметить результаты ниациновой пробы,
в) определить чувствительность микобактерий к антимикробным препаратам: отметить наличие или отсутствие роста микобактерий на среде Левенштейна-Йенсена с разными концентрациями противотуберкулезных препаратов и сопоставить полученные данные с клиническими границами устойчивости микобактерий. Дать окончательное заключение по проведенным исследованиям.
Методические указания
Материал для исследования: при легочном туберкулезе материалом для исследования являются мокрота, промывные воды бронхов, бронхоальвеолярная жидкость, плевральный экссудат, промывные воды желудка. Образцы мокроты необходимо собирать в течение 3-6 дней. При внелегочном туберкулезе материал для исследования выбирают в зависимости от локализации поражений. Это может быть кровь, спинномозговая жидкость, моча, синовиальная жидкость, тканевые биоптаты (лимфатических узлов, костного мозга, печени, кожи и подкожной жировой клетчатки и др.), испражнения. Нестерильный материал, контаминированный нормальной микрофлорой, для предотвращения размножения посторонних бактерий сразу после отбора должен быть помещен в холодильник и храниться до исследования при температуре 4-8 °С.
Первичная обработка клинического материала. Нестерильный материал нуждается в предварительной деконтаминации. Для исследования вязкого и негомогенного материала, содержащего тканевой детрит (мокрота, бронхоальвеолярная жидкость и др.), требуется также произвести процедуру разжижения и гомогенизации. Поскольку клинические образцы обычно содержат малое количество микобактерий, желательно производить обогащение исследуемого материала. Обычно с целью гомогенизации/деконтаминации материал обрабатывают муколитическими (N-ацетил-L-цистеин) и антибактериальными агентами (10 % Nа3РO4, 1-2 % NаОН и др.). Далее бактерии концентрируют путем осаждения в ходе центрифугирования. При этом клеточный детрит и погибшие посторонние микроорганизмы удаляются в виде супернатанта. Осадок ресуспендируют в минимальном объеме стерильной воды или изотонического раствора NaCl и используют для дальнейшего исследования. Тканевые биоптаты перед исследованием необходимо гомогенизировать.
Бактериоскопическое исследование (схема 11). Бактериоскопическая диагностика туберкулеза основана на выявлении в материале кислотоустойчивых бактерий с помощью специальных сложных методов окраски. Выявление микобактерий классическим методом Циля-Нильсена является весьма трудоемкой процедурой. Кислотоустойчивые бактерии окрашиваются в ярко-красный цвет, располагаются поодиночке или небольшими скоплениями. Препараты из мочи обязательно обесцвечивают не только кислотой, но и спиртом для дифференциации М.tuberculosis от М.smegmatis, которые могут находиться в моче здоровых людей. В отличие от М.tuberculosis они обесцвечиваются спиртом.
Мазок исследуют иммерсионным методом при увеличении 900х-1000х, просматривая до 300 полей зрения. Результат считается положительным при обнаружении 1 или более кислотоустойчивых бактерий на 100 полей зрения. Отсутствие кислотоустойчивых бактерий при просмотре 300 полей зрения следует трактовать как отрицательный результат. Окраску по методу Циля-Нильсена применяют преимущественно для изучения выделенных чистых культур.
В качестве основного метода выявления микобактерий в материале от больного применяют люминесцентную микроскопию мазков, окрашенных флюорохромом аурамином О по методу Боя (последующая обработка 3 % раствором НС1 в абсолютном этаноле обеспечивает обесцвечивание некислотоустойчивых бактерий). Этот метод облегчает исследование, поскольку позволяет использовать меньшее увеличение (250х или 450х) и просматривать меньшее число полей зрения (30-70 в зависимости от увеличения). Независимо от метода окраски бактериоскопическое исследование позволяет обнаружить бактерии при их концентрации не менее 5000-10 000 в 1 мл образца, поэтому отрицательный результат не позволяет исключить заболевание.
Микроскопическое исследование является ориентировочным и дает возможность судить лишь о наличии в материале кислотоустойчивых бактерий без определения их видовой принадлежности. Метод не позволяет дифференцировать микобактерии между собой и от других кислотоустойчивых микроорганизмов. Легочные и внелегочные поражения в первую очередь у лиц с иммунодефицитом различной этиологии могут быть вызваны не только бактериями комплекса М.tuberculosis (МТС), но также и нетуберкулезными микобактериями: бактериями комплекса М.аvium (МАС), М.kansassii, реже другими представителями рода Мусоbacterium. Поскольку нетуберкулезные микобактерии являются обитателями окружающей среды, загрязняющими воду, продукты, они могут также присутствовать в образце как контаминанты.
Бактериоскопическое исследование считается оптимальным методом ориентировочной экспресс-диагностики туберкулеза.
Бактериологическое исследование. Считается ведущим методом диагностики туберкулеза. Для выделения чистой культуры микобактерии производят посев исследуемого материала на специальные жидкие или плотные питательные среды. Для выделения микобактерии из нестерильного материала желательно использовать селективные среды, содержащие антимикробные препараты, подавляющие рост посторонних микробов. Для культивирования микобактерии применяют плотные яичные (среда Левенштейна-Йенсена) и агаровые среды, а также ряд синтетических жидких питательных сред. Рекомендуется осуществлять посев одновременно на плотную и жидкую среду. Посевы необходимо инкубировать в атмосфере с повышенным содержанием СО2 (5-10 %). Минимальный срок инкубации составляет не менее 8 нед. Посевы первый раз просматривают на 3-5-й день после внесения материала, далее - 2 раза в неделю. Начиная с 5-й недели культивирования - 1 раз в неделю. Культуры М.tuberculosis имеют вид сероватого или светло-кремового морщинистого или крошкообразного сухого налета.
Еще до появления видимых невооруженным глазом макроскопических колоний на плотных средах с помощью микроскопии могут быть обнаружены микроколонии. Отсутствие микробного роста через 8 нед. культивирования следует расценивать как отрицательный результат.
В последнее время широкое применение нашли различные коммерческие системы культивирования микобактерии, использующие как жидкие, так и плотные питательные среды, а также различные высокочувствительные способы автоматизированного контроля роста бактерий на основании их метаболической активности - по потреблению компонентов питательной среды и/или образованию продуктов жизнедеятельности. Это позволяет обнаружить присутствие бактерий значительно раньше появления видимых признаков роста. Использование указанных методов контроля роста позволяет в большинстве случаев существенно ускорить процесс выделения чистой культуры микобактерии. Положительный результат может быть получен уже через 3-5 дней, средний срок составляет 7-14 дней. Однако, учитывая вероятную низкую концентрацию возбудителя в исследуемом материале, максимальный срок инкубации достаточно велик - результат бактериологического исследования считается отрицательным при отсутствии признаков роста в течение 40 дней. В случае регистрации положительного результата культивирование продолжают до тех пор, когда количество бактерий в среде достигает определенной концентрации, необходимой для проведения дальнейшего изучения выделенной чистой культуры - идентификации и определения чувствительности к антимикробным препаратам. Среднее время культивирования составляет 9-20 дней.
Бактериологический метод дает положительный результат при наличии не менее 10-30 жизнеспособных микобактерии в 1 мл исследуемого материала после обогащения. Отрицательный результат в ряде случаев может быть обусловлен очень низким содержанием возбудителя в клиническом образце.
Идентификация чистой культуры. Выделенные чистые культуры микобактерий обычно идентифицируют до вида. Традиционные методы идентификации основаны на изучении достаточно большого числа признаков, включая скорость роста, морфологию колоний, способность к пигментробразованию, продукции никотиновой кислоты, восстановлению нитратов и теллурита калия, гидролизу твина-80, мочевины (уреазная активность), пиразинамида до пиразиновой кислоты (пиразинамидазная активность), перекиси водорода при повышенной температуре (термоустойчивая каталазная активность) и некоторых других. На основании этих признаков можно однозначно идентифицировать представителей основных видов Мусоbacterium spp, вызывающих заболевания человека. Процедура идентификации по фенотипическим признакам может занимать до 3 нед. Специфичность метода доставляет 100%.
Способность исследуемой культуры синтезировать никотиновую кислоту (ниациновая проба Конно) является одним из важных признаков, с помощью которого удается отличить М.tuberculosis, хорошо синтезирующие никотиновую кислоту, от М.bovis, образующих ее в минимальных количествах. Для определения ниацина к культуре микобактерий в жидкой питательной среде добавляют 1 мл раствора КCN и 1 мл 5 % раствора хлорамина. При наличии ниацина через несколько минут появляется ярко-желтая окраска. Для нейтрализации КCN после учета результатов реакции в пробирки добавляют 3-5 мл 10 % раствора гидрокарбоната натрия.
Схема 11. Микробиологическое исследование при туберкулезе
|
При выращивании микобактерий на предметных стеклах (метод микрокультур Прайса) вирулентные штаммы характеризуются ростом в виде жгутов или кос за счет образования корд-фактора. На нескольких предметных стеклах делают толстые мазки, высушивают, обрабатывают несколько минут 2-6 % серной кислотой и нейтрализуют. Затем стекла опускают во флаконы с гемолизированной цитратной кровью в разведении 1:4-1:8 и ставят в термостат. Через 7-14 дней извлекают стекла, фиксируют препарат, окрашивают по методу Циля-Нильсена и микроскопируют.
Метод гибридизации ДНК ("ДНК-зондов") применяют для быстрой идентификации чистой культуры микобактерий. Использование ДНК-зондов позволяет получить окончательный ответ в течение суток после завершения культивирования. На сегодня существуют ДНК-зонды для идентификации только наиболее клинически значимых и широко распространенных микобактерий, вызывающих заболевания человека.
Идентификация микобактерий по липидному составу (хемоидентификация) с помощью газожидкостной или жидкостной хроматографии. Метод позволяет осуществить идентификацию любого из известных 50 видов микобактерий в течение 4 ч. Основными факторами, ограничивающими его широкое применение, являются необходимость использования дорогостоящего оборудования и техническая сложность интерпретации результатов.
Определение чувствительности возбудителя к антибиотикам является обязательным этапом диагностики туберкулеза и основой назначения адекватной терапии. Традиционно определение чувствительности микобактерий осуществляют методом серийных разведений препарата в питательной среде. Исследование может занимать более 3 нед. (до 3 мес.), что обусловлено чрезвычайно низкой скоростью роста резистентных вариантов.
Применение современных молекулярно-генетические методов определения чувствительности микобактерий к антимикробным препаратам позволяют обнаружить наличие у возбудителя генов, контролирующих резистентность к определенному препарату. Уже разработаны тест-системы на основе ПЦР для определения резистентности к препаратам группы рифампицинов.
Биопроба. Применяли ранее для диагностики туберкулеза: чистую культуру М.tuberculosis выделяли из органов животного, зараженного исследуемым материалом. В настоящее время метод практически не применяется.
Экспресс-методы диагностики. Биохимические и молекулярно-биологические исследования. Метод ПЦР позволяет обнаружить наличие видоспецифических нуклеиновых кислот микобактерий непосредственно в клиническом образце после обогащения. Исследование занимает около 4 ч. Существующие коммерческие тест-системы позволяют выявить в образце присутствие МТС - бактерий комплекса М.tuberculosis (М.tuberculosis, М.bovis/BCG, М.africanum) и надежно дифференцировать их от нетуберкулезных микобактерий. Результаты ПЦР-диагностики рекомендуется интерпретировать в зависимости от данных бактериоскопического исследования. Получение положительного ответа бактериоскопическим методом и ПЦР позволяет диагностировать туберкулез и рекомендовать немедленное назначение противотуберкулезных препаратов по классической схеме. Отрицательный результат ПЦР при наличии кислотоустойчивых микобактерий в мазках позволяет исключить присутствие МТС и рекомендовать назначение антимикробных препаратов, активных в отношении нетуберкулезных микобактерий.
Серодиагностика. Антитела к антигенам возбудителя в крови пациентов можно обнаружить с помощью РСК, РНГА и других серологических реакций. Необходимо иметь в виду, что положительные результаты отмечаются не только при активном туберкулезном процессе в организме, но также при инфицировании М.tuberculosis и вакцинации, поэтому диагностического значения не имеют.
Кожно-аллергическая проба.Ставится с туберкулином - очищенной белковой фракцией, полученной из фильтрата бульонной культуры М.tuberculosis. Используется для оценки течения туберкулезного процесса, определения эффективности вакцинации и отбора контингентов для ревакцинации против туберкулеза. Туберкулин вводят внутрикожно в строго определенной дозировке (реакция Манту). Результаты учитывают через 24-48 ч.
Диагностические, профилактические и лечебные препараты
Туберкулин сухой очищенный (РРD). Получен из фильтрата бульонной культуры микобактерии путем добавления химических веществ, осаждающих белок, с последующей очисткой и лиофилизацией. Применяют для постановки кожно-аллергической пробы.
Вакцина ВСG. Живая лиофильно высушенная культура авирулентного штамма М.bovis BCG. Применяется внутрикожно для активной специфической профилактики туберкулеза.
Антибиотики. Для лечения туберкулеза обычно используют комбинации препаратов (не менее трех препаратов различных групп) с учетом чувствительности М.tuberculosis.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|