
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Лабораторная работа № 2. Ацидиметрическое определение солей.. Определение Na2CO3 в водном растворе технической соды. Ход работы
Лабораторная работа № 2
Ацидиметрическое определение солей.
Определение Na2CO3 в водном растворе технической соды
Цель: ацидиметрически определить Na2CO3 в водном растворе технической
соды
Посуда и реактивы:мерная колба, коническая колба, бюретка, индикатор
метиловый оранжевый, раствор Na2CO3, дистиллированная вода, титрованный
раствор HCl.
Задание: выполнить опыты, оформить отчет.
Правила техники безопасности:
1. Правила работы с реактивами.
2. Правила работы с химической посудой.
Методические рекомендации к выполнению лабораторной работы:
Карбонат натрия является солью, образованной сильным основанием и очень слабой двухосновной угольной кислоты, вследствие этого гидролизуется и имеет в растворе щелочную реакцию среды. Гидролиз Na2CO3 протекает по уравнению:
Na2CO3 + H2O = NaOH + NaHCO3
В присутствии фенолфталеина до начала титрования раствор Na2CO3 окрашен в малиновый цвет (щелочная форма фенолфталеина).
Эта окраска остается неизменной до тех пор, пока полностью пройдет реакция
Na2CO3 + H2O = NaOH + NaHCO3
NaOH + HCl= NaCl + H2O,
NaHCO3 + HCl = NaCl + H2O + CO2
Na2CO3 + 2HCl = 2NaCl+ H2O + CO2
Ход работы
Анализируемый раствор соды разбавляют дистиллированной водой в мерной колбе до 100 мл. Полученный раствор тщательно перемешивают. В коническую колбу отбирают 10 мл разбавленного раствора соды, прибавляют 1-2 капли индикатора метилового оранжевого и титруют раствором соляной кислоты с известным титром до перехода желтой окраски раствора в оранжевую.
Повторив титрование 3-5 раз, вычисляют массу соды в растворе:
m( 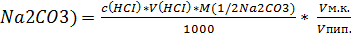
где с(HCl) - молярная концентрация эквивалента соляной кислоты, моль/л;
V(HCl) - обьем кислоты, затраченной на титрование пробы, мл;
Vпип - обьем пипетки, мл;
M(1/2Na2CO3) -молярная масса эквивалента Na2CO3, г/моль, 53 г/моль;
Vмк - обьем мерной колбы, мл.
Расчет повторить через условный титр Т(HCl/ Na2CO3) .
Контрольные вопросы:
1. Какие методы количественного химического анализа называют «титриметрическими»?
2. Какие инструменты используют для титриметрического анализа?
3. Какой параметр выступает в качестве интенсивности аналитического сигнала в титриметрическом анализе?
4. В чем заключается титрование?
5. Какой раствор в титриметрии называют «стандартным, рабочим, титрованным, титрантом»?
6. Какими способами готовят стандартные растворы?
7. Какие титриметрические методы относят к кислотно-основным (протолиметрическим)?
8. Какие вещества можно количественно определить прямым, обратным и заместительным кислотно-основным титрованием? Приведите примеры.
9. Чем отличается алкалиметрия от ацидиметрии в протолиметрии?
10. Какие индикаторы могут быть использованы в качестве индикаторов при кислотно-основном титровании?
11. Техника безопасности при выполнении работы.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|