
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тема «Окислительно-восстановительные реакции»
Тема «Окислительно-восстановительные реакции»
Задание. Используя метод электронного баланса, расставьте коэффициенты в схемах следующих окислительно-восстановительных реакций:
1. NH3 + O2 à NO + H2O
2. P + HNO3 + H2O à H3PO4 + NO
3. C + HNO3 à CO2 + NO + H2O
4. H2S + O2 à SO2 + H2O
5. FeS + O2 à SO2 + Fe2O3
Образец выполнения задания
| Расставить коэффициенты в реакции, схема которой: HCl + MnO2 = Cl2 + MnCl2 + H2O |
| Алгоритм расстановки коэффициентов |
1.Указываем степени окисления химических элементов.
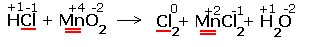 Подчёркнуты химические элементы, в которых изменились степени окисления.
Подчёркнуты химические элементы, в которых изменились степени окисления.
|
2.Составляем электронные уравнения, в которых указываем число отданных и принятых электронов.
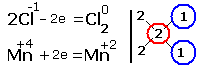 За вертикальной чертой ставим число электронов, перешедших при окислительном и восстановительном процессах. Находим наименьшее общее кратное (взято в красный кружок). Делим это число на число перемещённых электронов и получаем коэффициенты (взяты в синий кружок). Значит, перед марганцем будет стоять коэффициент-1, который мы не пишем, и перед Cl2 тоже -1. Перед HCl коэффициент 2 не ставим, а считаем число атомов хлора в продуктах реакции. Оно равно - 4.Следовательно, и перед HCl ставим - 4,уравниваем число атомов водорода и кислорода справа, поставив перед H2O коэффициент - 2. В результате получится химическое уравнение:
За вертикальной чертой ставим число электронов, перешедших при окислительном и восстановительном процессах. Находим наименьшее общее кратное (взято в красный кружок). Делим это число на число перемещённых электронов и получаем коэффициенты (взяты в синий кружок). Значит, перед марганцем будет стоять коэффициент-1, который мы не пишем, и перед Cl2 тоже -1. Перед HCl коэффициент 2 не ставим, а считаем число атомов хлора в продуктах реакции. Оно равно - 4.Следовательно, и перед HCl ставим - 4,уравниваем число атомов водорода и кислорода справа, поставив перед H2O коэффициент - 2. В результате получится химическое уравнение:
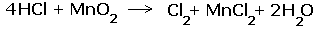
|
| Рассмотрим более сложное уравнение: |
| H2S + KMnO4 + H2SO4 =S + MnSO4 + K2SO4 + H2O |
Расставляем степени окисления химических элементов:
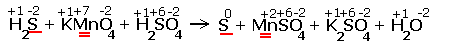
|
Электронные уравнения примут следующий вид
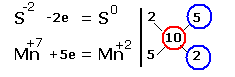 Перед серой со степенями окисления -2 и 0 ставим коэффициент 5, перед соединениями марганца -2, уравниваем число атомов других химических элементов и получаем окончательное уравнение реакции
Перед серой со степенями окисления -2 и 0 ставим коэффициент 5, перед соединениями марганца -2, уравниваем число атомов других химических элементов и получаем окончательное уравнение реакции
|
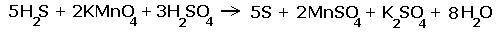
|
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|