
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Химические соединения. КРИСТАЛЛИЗАЦИЯ МЕТАЛЛОВ
Химические соединения
Химические соединения, встречающиеся в металлических сплавах, очень разнообразны. Они отличаются от твёрдых растворов следующими признаками: 1) имеют строго определённый состав и химическую формулу AmBn , где А и В – соответствующие элементы, n и m – простые числа; 2) кристаллическая решётка химического соединения отличается от решёток компонентов, образующих соединения; 3) свойства химических соединений сильно отличаются от свойств образующих элементов; 4) они имеют постоянную температуру плавления; 5) образование химического соединения сопровождается значительным тепловым эффектом.
В отличие от твёрдых растворов химические соединения обычно образуются между элементами, которые имеют большое различие в строении атомов и кристаллических решёток.
Наилучшие механические свойства имеют те сплавы, основой которых являются твёрдые растворы с залегающими в них мелкодисперсными твердыми частицами химических соединений или промежуточных фаз. Чем больше в сплаве таких частиц, тем выше его твёрдость и прочность, но ниже пластичность и вязкость.
КРИСТАЛЛИЗАЦИЯ МЕТАЛЛОВ
Переход металла из жидкого состояния в твердое называется кристаллизацией. При кристаллизации система переходит к термодинамически более устойчивому состоянию с меньшей свободной энергией. Изменение свободных энергий жидкого Fж и твердого Fтв металла зависит от температуры (рис. 2.1).
Выше температуры Т0 более устойчив жидкий металл. Он имеет меньший запас свободной энергии, а ниже этой температуры более устойчив твердый металл. Температуру Т0 называют равновесной температурой кристаллизации. При этой температуре одновременно могут сосуществовать жидкая и твердая фаза.
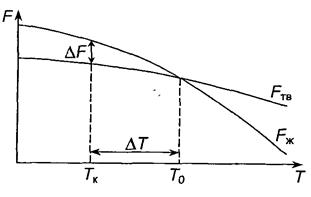
Рис. 2.1. Изменение свободных энергий F жидкого и твёрдого
металла с температурой
Процесс кристаллизации при этой температуре еще не начинается. Он может протекать только при переохлаждении металла ниже Т0. Разность между температурами Т0 и Тк называется степенью переохлаждения
DТ= Т0 –Тк.
Кривые охлаждения, характеризующие процесс кристаллизации чистых металлов при охлаждении с разной скоростью, показаны на рис. 2.2.
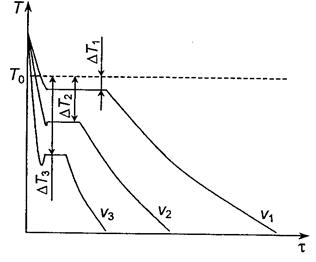
Рис. 2.2. Кривые охлаждения металла
при кристаллизации.
Скорости охлаждения n1<n2<n3
При очень медленном охлаждении степень переохлаждения DТ небольшая и процесс кристаллизации протекает при температуре, близкой к равновесной Т0. С увеличением скорости охлаждения степень переохлаждения возрастает. При затвердевании очень чистых металлов степень переохлаждения может быть большой, но для технически чистых она не превышает 10…30 °С.
При температуре кристаллизации наблюдается горизонтальная площадка (остановка падения температуры). Образование ее объясняется выделением скрытой теплоты кристаллизации.
Процесс кристаллизации начинается с образования внутри жидкой фазы кристаллических зародышей, которые являются центрами кристаллизации. Затем происходит рост зародышей.
Чаще всего в процессе кристаллизации образуются разветвленные (древовидные) кристаллы, получившие название дендритов. При образовании кристаллов их развитие идет в направлении, перпендикулярном к плоскостям с максимальной плотностью упаковки атомов. Сначала образуются длинные ветви, которые называют осями первого порядка. Одновременно с удлинением осей первого порядка перпендикулярно к ним начинают расти оси второго порядка. На осях второго порядка растут оси третьего порядка и т.д. В последнюю очередь идет кристаллизация в участках между осями дендритов (рис. 2.3).
Дендриты растут до тех пор, пока не соприкоснутся друг с другом. Затем заполняются межосные пространства. Дендриты превращаются в кристаллы неправильной формы, которые называют кристаллитами или зернами.
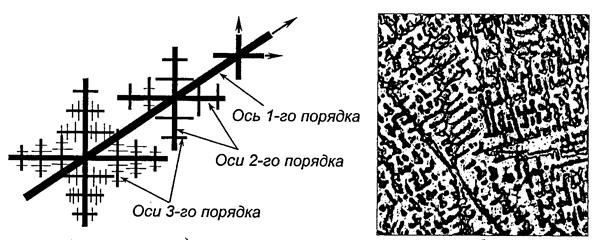
а) б)
Рис. 2.3. Схема строения дентдрита (а) и вид дендритной структуры на шлифе (б)
Кристаллизация характеризуется двумя параметрами: ЧЦ – число зародышевых центров, которые возникли в единице объема жидкого металла за единицу времени; СР – скорость роста, то есть путь, проходимый растущей гранью кристалла за единицу времени.
Зародыши могут образовываться как в определенных объемах жидкости, так и на посторонних твердых частицах, присутствующих в жидком металле.
Первый способ образования зародышевых центров называется самопроизвольным, а второй – несамопроизвольным.
В жидком состоянии атомы беспорядочно перемещаются вследствие теплового движения. Но в жидкости есть небольшие группировки атомов с таким расположением, как в решетке кристалла. Эти группировки неустойчивы – они распадаются и появляются снова. При переохлаждении наиболее крупные из них становятся устойчивыми и способными к росту. Эти группировки являются зародышевыми центрами при самопроизвольной кристаллизации. Но самопроизвольное зарождение кристаллов в жидком металле затруднено.
Чаще зародышевые центры образуются на посторонних твердых частицах, присутствующих в жидком металле.
Размер зерен при затвердевании определяется соотношением количества возникающих зародышей и скорости их роста. Чем больше ЧЦ и меньше СР, тем мельче образовавшиеся кристаллы. Оба параметра связаны с перемещением атомов и поэтому зависят от температуры.
При небольших степенях переохлаждения количество зародышевых центров мало. В результате затвердевания формируется крупнозернистая структура. С увеличением степени переохлаждения число зародышевых центров растет более интенсивно по сравнению со скоростью роста. Поэтому получаются более мелкие кристаллы. Следовательно, чем больше скорость охлаждения при кристаллизации, тем мельче получается зерно. Для получения мелкого зерна в жидкий металл часто вводят специальные примеси. Этот процесс называют модифицированием [1].
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|