
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Figure 2: Invertebrate prey items relative importance in the diet of Ceratophrys stolzmanni (n = 31), as deduced from their gastrointestinal tract contents.
ЧТО ЖРЁТ ПАКМАН?
Мы впервые описываем экологию кормления тихоокеанской рогатой лягушки (Ceratophrys stolzmanni), которая определяется с помощью анализа содержимого желудочно-кишечного тракта и поведенческих наблюдений в его естественной среде обитания. Поглощенная добыча у взрослых варьировалась от клещей и различных насекомых до лягушек и змей. Объекты питания состояли в основном из брюхоногих моллюсков, неформовидных перепончатокрылых и многоножек. Мы не обнаружили никакой связи между размером хищника и добычей, с точки зрения размера добычи, объема или количества поглощаемых предметов. Дополнительные прямые наблюдения показывают, что все постметаморфические стадии прожорливы: они охотятся на позвоночных и участвуют в анурофагии, каннибализме и даже некрофагии. Наше исследование проливает свет на привычки питания одного из наименее известных видов рогатых лягушек.
Критическим первым шагом в понимании экологии хищника является знание его пищевых предпочтений и стратегии кормления. Данные о типе потребляемой добычи улучшают наше понимание стратегии кормления вида и раскрывают его положение в трофической сети (Jiang & Morin, 2005). Во многих экосистемах, особенно в тропиках, амфибии являются наиболее многочисленными позвоночными (Stebbins & Cohen, 1995), поэтому они могут оказывать существенное влияние на пищевые сети, как на хищников, так и на добычу (Semlitsch, O'Donnell & Thompson, 2014). ).
Лягушки и жабы поглощают свою жертву целиком, поэтому они считаются хищниками с ограниченным зевом (Wells, 2010). Следовательно, ширина их головы является хорошим лимитирующим фактором размера жертвы, которую они могут проглотить (Emerson, 1986). В результате существует тенденция к тому, что более крупные особи или животные с более широким ртом потребляют более крупные предметы добычи как между особями разных размеров одного и того же вида (Lima & Moreira, 1993; Wu et al., 2005), но в некоторой степени также между различные виды (Toft, 1980; Lima & Magnusson, 1998; Isacch & Barg, 2002). Среди бесхвостых амфибий одно семейство, которое, по-видимому, извлекает выгоду из ряда морфологических признаков, связанных с макрофагией, представляет собой Ceratophryidae (Emerson, 1985). Виды, принадлежащие к этому семейству, имеют непропорционально большой, крепкий череп по отношению к размеру их тела (отсюда и название лягушек Пакмана, употребляемое в народе для видов Ceratophrys), уменьшенную длину черепа, связанную с увеличением ширины черепа (Fabrezi, 2006) и клыки ( Fabrezi & Emerson, 2003; рис. S1). Способность поглощать очень крупную добычу позволяет этим животным использовать разнообразные пищевые ресурсы, что приводит к диете, которая состоит из разнообразных беспозвоночных, рептилий (Chavez, Venegas & Lescano, 2011), мелких птиц и млекопитающих (Duellman & Lizana, 1994; Schalk et al., 2014) и значительной доли земноводных (Hulse, 1978; Pueta & Perotti, 2013; Stănescu, Marangoni & Reinko, 2014).
Среди рогатых лягушек одним из видов, для которого не хватает информации о привычках питания, является тихоокеанская рогатая лягушка Ceratophrys stolzmanni, роющая амфибия, известная всего в нескольких местах в прибрежных сухих лесах в Перу и Эквадоре (IUCN Amphibian Specialist Group, 2018) , Вид закапывающийся и ночной. Особи остаются зарытыми в земле большую часть своей жизни, и выходят из своих нор только после проливных дождей. Из-за его редкой активности и небольшого распространения было проведено мало исследований, касающихся экологии вида (Székely et al., 2017, 2018b). Тихоокеанские рогатые лягушки обитают в сезонных условиях, причем сухой сезон составляет не менее 4 месяцев с ежемесячным количеством осадков менее 10 мм (Espinosa et al., 2016). Лягушки отдыхают в течение этого интервала и возвращаются к активности и размножаются сразу после первых проливных дождей сезона дождей (Székely et al., 2018a). Однако даже в сезон дождей они, по существу, активны над землей только во влажные ночи. Первые подростки начинают метаморфоз в конце марта - апреле, в зависимости от режима осадков; у них меньше 3 месяцев, как правило, до конца июня, чтобы прокормиться и вырасти настолько, чтобы они могли пережить последующее сидение. Предыдущее исследование показало, что молодые особи этого вида удваиваются в размерах и достигают половой зрелости менее чем через год после метаморфоза (Székely et al., 2018b), несмотря на короткий сезон, в котором они активны.
Мы опишем здесь первые наблюдения за рационом тихоокеанской рогатой лягушки, полученные в течение дождливого сезона (январь – апрель) в течение 2 лет (2015–2016 гг.) в естественной среде обитания вида. Помимо сообщений о разнообразии потребляемой добычи, мы также исследовали влияние размера хищника на его рацион; мы предполагаем, что особи с более широкими головами будут поглощать более крупную добычу (Quiroga, Sanabria & Acosta, 2009). Мы также ожидали положительную корреляцию между размером хищника и потребляемой им пищей с точки зрения количества продуктов или объема пищи (Basso, 1988; Biavati, Wiederhecker & Colli, 2004), и что более крупные особи будут стремиться избегать употребления мелких продуктов (Уитфилд и Дон)
Материалы и методы
Заявление об этике
Это исследование было проведено в строгом соответствии с руководящими принципами использования живых амфибий и рептилий в полевых исследованиях, составленными Американским обществом ихтиологов и герпетологов, Лигой герпетологов и Обществом по изучению амфибий и рептилий. Разрешение на проведение исследований было выдано Министром дель Амбьенте дель Эквадора (MAE-DNB-CM-2015-0016). Это исследование было оценено и одобрено Комитетом по этике Университета Техника Паркуле де Лоха.
Учебный сайт
Исследование проводилось в Экологическом заповеднике Аренильяс, провинция Эль-Оро, юго-запад Эквадора (03 ° 34 'ю.ш .; 80 ° 08' в.д., 30 м.д.). Заповедник Arenillas является низменным тропическим сухим лесом, с относительно стабильным климатом с точки зрения температуры (средняя годовая температура 25 ° C, с колебаниями 3.4 ° C между самыми холодными и самыми теплыми месяцами), но заметно сезонными в дожде с осадками почти исключительно ограничено 4 месяцами сезона дождей (январь – апрель; в среднем 515 мм из 676 мм годовых осадков). Сухой сезон длится не менее 4 месяцев с ежемесячным количеством осадков менее 10 мм (Espinosa et al., 2016). Всего из заповедника сообщается о 10 видах земноводных (Székely et al., 2016), одним из которых является C. stolzmanni.
Полевые работы проводились в сезон дождей (январь – апрель) в 2015 году (38 дней) и 2016 году (65 дней). Из-за статуса сохранения вида (Уязвимые согласно IUCN Amphibian Specialist Group, 2018), мы решили использовать только неинвазивные методы: анализ содержимого желудочно-кишечного тракта (ЖКТ) животных, найденных мертвыми, и непосредственное наблюдение за поведением при кормлении животных в их естественной среде обитания.
Анализ содержимого желудочно-кишечного тракта (ЖКТ). Анализ содержимого желудочно-кишечного тракта был проведен на 14 дорожных убийствах и 23 особях, найденных мертвыми (предположительно утопленными) в репродуктивных прудах после массовых спариваний. У рогаток репродуктивные события бывают внезапными и непродолжительными, длящимися всего одну ночь (Székely et al., 2018a), и особи продолжают кормиться, даже находясь в амплексусах (Schalk & Montaña, 2011; Schalk et al., 2014). Мы использовали только недавно убитых животных с неповрежденными брюшными полостями. Чтобы свести к минимуму эффект пищеварения, особи были вскрыты в течение 2 часов после сбора. Все содержимое всей пищеварительной системы, ото рта до любых непереваренных предметов, обнаруженных в задней кишке, хранилось в пластиковых пробирках, заполненных 96% -ным спиртом, до обследования. Поскольку несовершеннолетние чрезвычайно деликатны, они сильно пострадали от столкновения с транспортными средствами. Поэтому в нашем исследовании нельзя было использовать несовершеннолетних, и выборка состояла исключительно из взрослых. Для каждого индивидуума мы записывали пол, мужчины распознавались по наличию вторичных половых признаков (т. Е. Темная окраска на горле и брачные мозоли на передних конечностях; Ortiz, 2018). В зависимости от состояния лягушки мы также измерили длину дыхательного отверстия (SVL) и ширину головы (HW) с помощью штангенциркуля Dial-Max (точность 0,1 мм), а также массу тела (BM) с помощью портативной шкалы My Weigh Triton T3 (Точность 0,01 г). Образцы, пригодные для консервации, были сданы на хранение в Зоологический музей Католического университета Эквадора, Кито, Эквадор и Зоологический музей, Университет Техники, в частности Лоха, Лоха, Эквадор (Таблица S1).
Содержимое желудочно-кишечного тракта анализировали в лаборатории с использованием стереомикроскопа Olympus SZ61 с прикрепленным глазным микрометром. Предметы добычи подсчитывались и идентифицировались по минимально возможной таксономической группе, обычно по порядку. Численность конкретного типа добычи (nx%) рассчитывалась как процент встреченных предметов этого типа от общего числа предметов добычи, в то время как частота встречаемости (fx) была процентом животных, которые содержали особый тип добычи от общего числа животных, которые содержали пищу в своем ЖКТ. Для каждого целого предмета добычи максимальная длина и ширина были измерены с точностью до 0,1 мм. Для полуусвоенной или неполной добычи мы оценили длину и ширину на основе их неповрежденных частей (например, тела, ног). Для добычи позвоночных животных точная оценка объема была невозможна, поэтому они были исключены из дальнейшего анализа. Оценка объема каждого предмета добычи проводилась с использованием формулы для вытянутого сфероида.
Существование взаимосвязей между размером хищника и количеством добычи, размером и объемом было исследовано с использованием корреляций Пирсона. Мы проверили наличие значительной корреляции между длиной тела (SVL) лягушки, с одной стороны, и количеством добываемых предметов, минимальным объемом отдельного предмета добычи или общим поглощенным объемом, с другой. Мы также проверили наличие корреляции между хищником HW и максимальной шириной добычи. Анализы проводились с использованием программного обеспечения SPSS (версия 21.0; IBM Corp., Армонк, Нью-Йорк, США) с уровнем значимости 0,05. Значения представлены как среднее ± S.E.
Прямое наблюдение за поведением при кормлении. Полевые исследования в районе исследования проводились как днем, так и ночью. Всякий раз, когда мы сталкивались с рогатыми лягушками в процессе кормления, мы получали как можно больше информации, не беспокоя животное; избегали манипуляций, и животных фотографировали сверху, рядом с контрольным объектом. На основании этих фотографий их SVL были оценены с использованием программного обеспечения ImageJ 1.46r (Schneider, Rasband & Eliceiri, 2012). Однако, если во время наблюдения лягушка высвободила свою жертву, были пойманы и хищник, и жертва, их SVL измерялись с помощью штангенциркуля, а затем их отпускали.
Результаты
GIT контент-анализ. Из 37 собранных мертвых рогатых лягушек (19 самцов, 18 самок, SVL в диапазоне от 51,6 до 81,2 мм) шесть (16%) не имели обнаруживаемой пищи в ЖКТ. Из оставшихся 31 лягушки мы извлекли 197 видов добычи, относящихся к 12 таксонам (таблица 1), в том числе три вида позвоночных (две бесхвостых амфибии, Trachycephalus jordani и Leptodactylus labrosus и ювенильная змея Leptodeira septentrionalis; рис. 1). Среднее количество предметов добычи на человека составляло 6,4 ± 3,8 в диапазоне от 1 до 121.
Насекомые, брюхоногие моллюски и паукообразные представляют собой наиболее важную добычу, о чем свидетельствует индекс относительной важности; с точки зрения объема, брюхоногие моллюски (Pulmonata) и сороконожки (Chilopoda) составляли большую долю, в то время как численно клещи (Acari) и Hymenoptera без муравьев доминировали в рационе рогатых лягушек (Fig. 2). Поглощенная добыча беспозвоночных варьировалась по длине от 1 до 65 мм (среднее ± стандартное отклонение = 13,2 ± 1,6 мм) и по ширине от 1 до 16 мм (5,6 ± 0,6 мм). У 31 лягушки, у которой были предметы добычи, мы не обнаружили статистически значимой взаимосвязи между размером хищника и размером поглощенной жертвы. Общая длина (SVL) хищника не коррелировала с количеством содержащихся в нем предметов добычи (корреляция Пирсона; r = -0,108, p = 0,564, n = 31), общим объемом содержимого GIT (корреляция Пирсона; r = 0,197, р = 0,345, n = 25), или минимальный объем любого отдельного элемента, попавшего внутрь (корреляция Пирсона; r = -0,005, р = 0,981, n = 25). HW не коррелировал с максимальной шириной поглощенной добычи (корреляция Пирсона; r = 0,192, р = 0,357, n = 25).
Прямое наблюдение за поведением при кормлении. Наблюдаемое поведение включало в себя как хищничество, так и каннибализм (рис. 3). Мы были свидетелями 22 случаев, когда несовершеннолетние (стадия 46 Госнера, полностью рассосанный хвост, средний SVL = 29,6 ± 1,3 мм) совершали людоедские атаки на похожих или более молодых лягушек (хвост на разных стадиях рассасывания, SVL = 23,8 ± 1,2 мм, n = 18, остальные слишком далеко проглатываются, чтобы оценить размер). Среднее соотношение между хищником и добычей SVL составляло 1,26 (таблица S2). Жертва всегда была поймана головой вперед. В одном дополнительном случае мы не были свидетелями события, связанного с хищничеством, но дорсальная картина тихоокеанской рогатой лягушки была очевидна по прозрачности через растянутую кожу живота юноши-каннибала.
Мы встретили пять случаев, когда взрослый C. stolzmanni (средний SVL = 55,9 ± 2,4 мм) питался Leptodactylus labrosus (45,7 ± 3,2 мм, n = 4, один сбежал до того, как его можно было сфотографировать или измерить). Среднее соотношение между хищником и добычей SVL составляло 1,24 (таблица S2). Задняя часть укусила добычу, и рогатые лягушки использовали свои передние конечности, чтобы подчинить ее и обеспечить лучшее положение для приема пищи (Рис. 3C). В качестве защитного механизма, лягушки с белыми губами были раздуты и испустили высокий сигнал бедствия.
Necrophagy. 19 марта 2015 года около 23:00 на грунтовой дороге внутри заповедника мы встретили самца C. stolzmanni (SVL = 58 мм), который пытался проглотить самца T. jordani (SVL = 73 мм), который был мертв на дороге (рис. 3D). Состояние туши, которая была сплющена и частично высохла, свидетельствует о том, что убитая на дороге древесная лягушка была мертва в течение нескольких часов. Мы наблюдали пару около 10 минут. В течение этого интервала рогатая лягушка, покусав древесную лягушку за голову, подпрыгнула и использовала передние ноги, чтобы попытаться расположить свою явно более крупную добычу для облегчения приема пищи (Видео S1). Поскольку рогатая лягушка была заметно обеспокоена нашим присутствием и пыталась спрятаться под растительностью на обочине дороги, мы ушли. Мы не можем знать, была ли попытка кормления успешной.
Обсуждение
Немногочисленные исследования, касающиеся пищевых привычек видов Ceratophrys в их естественной среде обитания, показывают, что они являются универсальными и условно-патогенными хищниками (Pueta & Perotti, 2013; Schalk et al., 2014). Наше исследование показывает, что, как и его более крупные сородичи, тихоокеанские рогатые лягушки охотятся и потребляют разнообразные ресурсы. Универсальные хищники, переключающиеся между беспозвоночными и позвоночными животными, имеют больше возможностей для кормления и, следовательно, более высокие темпы роста по сравнению с более специализированными конкурентами (Caley & Munday, 2003; Berumen & Pratchett, 2008).
Для других видов этого рода, добыча позвоночных животных является преобладающей частью их рациона. Более глубокие исследования, касающиеся диеты C. cornuta (Duellman & Lizana, 1994), C. joazeirensis (Da Silva Jorge et al., 2015) и C. ornata (Basso, 1988), показывают, что позвоночные представляют большой объем (до 98%) и числовую (до 69%) долю их питания. В случае тихоокеанской рогатой лягушки только приблизительно 10% особей охотились на амфибий и рептилий, а позвоночные составляли 1,5% от всех поглощенных продуктов добычи. Однако, хотя продвинутое состояние пищеварения не позволило нам точно оценить их объем, они составляют большую часть общего потребляемого объема. Дополнительные прямые наблюдения анурофагии подтверждают, что такие события не случайны. Другие позвоночные, такие как грызуны и птицы, о которых сообщалось в рационе крупных видов цератофриса, таких как C. cornuta (Duellman & Lizana, 1994), C. cranwelli (Schalk et al., 2014) и C. ornata (Basso, 1988), имеют значительно меньшую вероятность быть добычей для тихоокеанской рогатой лягушки ввиду ее меньшего размера. Различия в количестве потребляемой добычи позвоночных животных, вероятно, также являются следствием меньшего размера C. stolzmanni.
У земноводных ширина рта ограничивает размер предметов, которые можно проглотить (Emerson, 1985). Действительно, ряд исследований показывает, что по мере того, как особи увеличиваются в размерах, их рацион также смещается в сторону более крупной добычи (Lima & Moreira, 1993; Hirai, 2002). В результате мы ожидали обнаружить, что более крупные рогатые тихоокеанские лягушки будут потреблять бОльшую добычу. Однако в нашем исследовании не было видно никакой связи между габаритами хищника и максимальным потребляемым продуктом. Отсутствие корреляции между хищником и жертвой, вероятно, связано с отсутствием неполовозрелых в нашей выборке. Исследование, проведенное в разных размерных классах, вероятно, подтвердит, что более крупные особи имеют доступ и едят более крупные продукты питания. С другой стороны, наши результаты показывают, что даже крупные особи захватывают и потребляют очень мелкие предметы добычи, такие как клещи и мелкие насекомые. Употребление в пищу мелкой добычи может быть полезным из-за более низких поведенческих затрат и рисков (например, обработка временных и энергетических затрат; риск получения травм) даже у более взрослых особей (Simon & Toft, 1991).
В некоторых аспектах таксономический состав добычи беспозвоночных у C. stolzmanni показал некоторые различия по сравнению с другими рогатками, по которым имеются данные. Важная часть их рациона состояла из моллюсков (Gastropoda), которые потреблялись почти половиной отобранных лягушек. Это контрастирует с редким появлением брюхоногих моллюсков у других Ceratophrys (Schalk et al., 2014). Доминирование муравьев (Formicidae), о котором сообщалось для C. cornuta (Duellman & Lizana, 1994) и C. aurita (Schalk et al., 2014), также не разделяется тихоокеанскими рогатыми лягушками, поскольку муравьи не представляют существенная часть их диеты. Хотя амфибии способны различать характеристики добычи, что приводит к последовательной селективности добычи (Freed, 1982), эти различия в рационе могут просто отражать несоответствия в доступности ресурсов, а не активный выбор. В будущих исследованиях, посвященных диете и доступности добываемых объектов, следует прояснить эти вопросы (Cogălniceanu et al., 2018).
Анурофагия и каннибализм. Большинство бесхвостых амфибий питаются в основном беспозвоночными (Pough et al., 2016), но некоторые виды иногда потребляют постметаморфических лягушат (Toledo, Ribeiro & Haddad, 2007). Это происходит с гораздо более высокой частотой у нескольких родов (Measey et al., 2015), таких как Lithobates (Bolek & Janvy, 2004; Silva et al., 2009), Leptodactylus (Rodrigues et al., 2011; Costa-Pereira et al., 2015) и Ceratophrys (Schalk et al., 2014). По крайней мере, два вида рода Ceratophrys проявляют сложное поведение при заманивании добычи (Murphy, 1976; Radcliffe et al., 1986), которое предположительно эволюционировало для привлечения визуально охотящейся добычи, например других бесхвостых амфибий (Hagman & Shine, 2008; Sloggett & Zeilstra, 2008). Кормление позвоночными выгодно: они являются источником энергии, которую легче переваривать по сравнению с большинством групп беспозвоночных, у которых жесткий экзоскелет (Secor, Wooten & Cox, 2007). Кроме того, более высокий белок позвоночных способствует быстрому росту (Grayson et al., 2005), в то время как высокое содержание воды в амфибийной добыче по сравнению с беспозвоночными может быть особенно выгодным в сезонно засушливой среде.
Хищничество внутри гильдии можно рассматривать как оппортунистическую форму хищничества (Toledo, Ribeiro & Haddad, 2007). В дополнение к филогенетической предрасположенности (Measey et al., 2015) этому поведению способствуют несколько условий окружающей среды, такие как совпадение в использовании среды обитания среди различных классов размеров (Wissinger et al., 2010), дефицит альтернативной добычи (Pizzatto & Shine, 2008) и высокая плотность амфибий (Polis & Myers, 1985). Условия, благоприятствующие каннибализму, выполняются, особенно в сезонных условиях (Blayneh, 1999). В районе исследований, вскоре после метаморфоза, плотность молоди C. stolzmanni в районе нерестовых прудов может достигать 25 особей / м2 (D. Székely, персональное наблюдение, 2016), и их способность поглощать крупную добычу увеличивает вероятность каннибализма. Наряду с предоставлением питательного источника пищи, потребление других бесхвостых, находящихся в той же среде обитания, также может быть полезным путем устранения потенциальных конкурентов (Polis, Myers & Holt, 1989; Finke & Denno, 2003).
Некрофагия. У некоторых видов бесхвостых на их личиночной стадии распространено поедание своих мертвых собратьев (Heinen & Abdella, 2005; Silva & Muniz, 2005; Kirchmeyer et al., 2015), поскольку головастики основывают распознавание продуктов питания на химических сигналах, обычно исходящими от источников для кормления (Altig , Whiles & Taylor, 2007). Однако сообщения о том, что взрослые потребляют туши любого типа, являются исключительными (Beane & Pusser, 2005; Tupper, Adams & Timm, 2009; Oda & Landgraf, 2012). У пост-метаморфических бесхвостых амфибий определенная модель движения необходима для распознавания добычи и, следовательно, для запуска атаки (Ewert, Burghagen & Schurg-Pfeiffer, 1983), так что трупы обычно игнорируются. Даже если у C. stolzmanni случается случайная уборка, наш доклад предполагает, что некоторые виды бесхвостых обладают большей диетической гибкостью, чем принято считать.
Выводы
Мы обнаружили, что Ceratophrys stolzmanni имеет относительно разнообразный рацион, как с точки зрения разнообразия добычи, так и размера. Способность питаться разнообразными типами добычи указывает на то, что этот вид способен использовать различные возможности кормления. Тем не менее, мы признаем, что число особей, использованных в этом исследовании, невелико, и мы все еще далеки от полного понимания привычек питания этого вида. Необходимы дальнейшие исследования по этому вопросу. Кроме того, исследования, посвященные тестированию потребленных и доступных ресурсов и конкурентных взаимодействий с другими видами, позволили бы сделать выводы относительно избирательности (или ее отсутствия) при выборе добычи. Такие исследования также позволят проверить наличие активных позвоночных в их рационе (Toft, 1981). Отсутствие селекции по добыче может иметь важные последствия для сохранения, предполагая, что вид может быть более устойчивым к изменениям в составе сообщества, вызванным изменением среды обитания (Raubenheimer, Simpson & Tait, 2012) или изменением разнообразия добычи (Lister & Garcia, 2018) , Кроме того, консументы общего назначения, особенно потребители более высокого порядка, могут оказывать стабилизирующее воздействие на пищевые цепи (Rooney et al., 2006). С другой стороны, можно предположить, что виды, которые часто участвуют во внутригильдийском хищничестве, каннибализме и некрофагии, могут быть особенно подвержены риску в случае возникающего заболевания или паразита, поскольку такое поведение увеличивает риск передачи различных заболеваний.
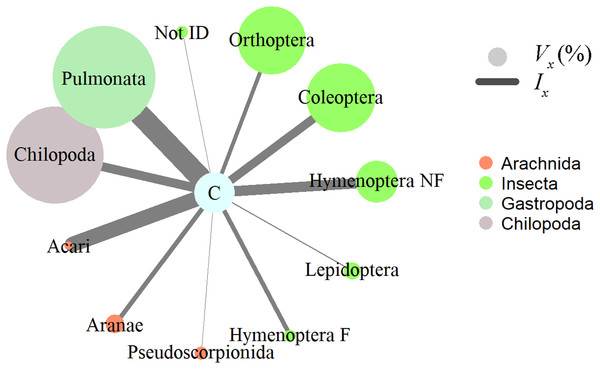
Figure 2: Invertebrate prey items relative importance in the diet of Ceratophrys stolzmanni (n = 31), as deduced from their gastrointestinal tract contents.
Vx (%), relative volume representation; Ix, index of relative importance. Hymenoptera F, Formicidae; Hymenoptera NF, non-formicid hymenopterans. Vertebrate prey encountered were not included in the analysis, due to the advanced state of digestion.

|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|